réservé à la recherche
Alvimopan Opioid Receptor antagoniste
N° Cat.S5935
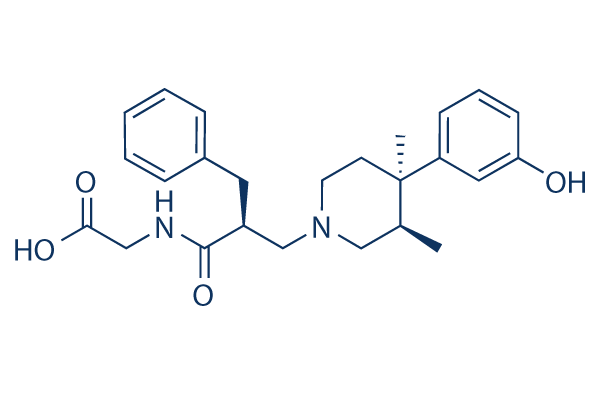
Structure chimique
Poids moléculaire: 424.53
Contrôle qualité
| Cibles apparentées | Adrenergic Receptor AChR 5-HT Receptor COX Calcium Channel Histamine Receptor Dopamine Receptor GABA Receptor TRP Channel Cholinesterase (ChE) |
|---|---|
| Autre Opioid Receptor Inhibiteurs | JTC-801 (+)-Matrine Racecadotril Trimebutine Docusate Sodium Trimebutine maleate Asimadoline hydrochloride BMS-986122 Naloxegol Oxalate methylnaltrexone bromide |
Informations chimiques, stockage et stabilité
| Poids moléculaire | 424.53 | Formule | C25H32N2O4 |
Stockage (À partir de la date de réception) | 3 years -20°C powder |
|---|---|---|---|---|---|
| N° CAS | 156053-89-3 | -- | Stockage des solutions mères |
|
|
| Synonymes | LY 246736, ADL 8-2698 | Smiles | CC1CN(CCC1(C)C2=CC(=CC=C2)O)CC(CC3=CC=CC=C3)C(=O)NCC(=O)O | ||
Solubilité
|
In vitro |
DMSO
: 85 mg/mL
(200.22 mM)
Water : Insoluble Ethanol : Insoluble |
Calculateur de molarité
|
In vivo |
|||||
Calculateur de formulation in vivo (Solution claire)
Étape 1 : Entrez les informations ci-dessous (Recommandé : Un animal supplémentaire pour tenir compte des pertes pendant lexpérience)
Étape 2 : Entrez la formulation in vivo (Ceci nest que le calculateur, pas la formulation. Veuillez nous contacter dabord sil ny a pas de formulation in vivo dans la section Solubilité.)
Résultats du calcul :
Concentration de travail : mg/ml;
Méthode de préparation du liquide maître DMSO : mg médicament prédissous dans μL DMSO ( Concentration du liquide maître mg/mL, Veuillez nous contacter dabord si la concentration dépasse la solubilité du DMSO du lot de médicament. )
Méthode de préparation de la formulation in vivo : Prendre μL DMSO liquide maître, ajouter ensuiteμL PEG300, mélanger et clarifier, ajouter ensuiteμL Tween 80, mélanger et clarifier, ajouter ensuite μL ddH2O, mélanger et clarifier.
Méthode de préparation de la formulation in vivo : Prendre μL DMSO liquide maître, ajouter ensuite μL Huile de maïs, mélanger et clarifier.
Remarque : 1. Assurez-vous que le liquide est clair avant dajouter le solvant suivant.
2. Assurez-vous dajouter le(s) solvant(s) dans lordre. Vous devez vous assurer que la solution obtenue lors de lajout précédent est une solution claire avant de procéder à lajout du solvant suivant. Des méthodes physiques telles que le vortex, les ultrasons ou le bain-marie peuvent être utilisées pour faciliter la dissolution.
Mécanisme daction
| Targets/IC50/Ki |
μ-opioid receptor
(Cell-free assay) 0.77 nM(Ki)
δ-opioid receptor
(Cell-free assay) 4.4 nM
δ-opioid receptor
(Cell-free assay) 4.4 nM(Ki)
κ-opioid receptor
(Cell-free assay) 40 nM(Ki)
|
|---|---|
| In vitro |
L'alvimopan est hautement sélectif (par ≥227 fois) pour le récepteur humain μ par rapport au sous-type κ, mais a une sélectivité μ/δ du récepteur plus modeste (≥6 fois). Dans l'iléon isolé de cobaye, ce composé est un puissant antagoniste de l'inhibition des contractions évoquées électriquement, induite par la morphine, le DAMGO ou l'endomorpine-1, et médiée par le récepteur μ Opioid Receptor (valeurs de pA2 de 9,6 ou 9,7). Les puissances antagonistes δ et κ de cette substance chimique sont plus faibles dans l'iléon de cobaye (valeurs de pA2 de 8,7 et 7,8, respectivement). Ce composé (1 ou 10 μM) n'a pas d'affinité significative pour un large éventail de récepteurs non opioïdes, de canaux ioniques et d'enzymes sur lesquels il a été testé. |
| In vivo |
Chez les animaux, l'alvimopan antagonise l'analgésie induite par la morphine, médiatisée au niveau central, uniquement à des doses relativement élevées, avec des concentrations plasmatiques très élevées nécessaires pour traverser la barrière hémato-encéphalique. Après administration intraveineuse, ce composé est environ 200 fois plus puissant pour bloquer les récepteurs μ périphériques que centraux. Après administration orale, il est également très actif. Chez les chiens, l'administration intraveineuse de cette substance chimique a entraîné des augmentations dose-dépendantes des concentrations plasmatiques maximales et de l'aire sous la courbe concentration-temps plasmatique. Cependant, en raison d'une mauvaise absorption systémique, des doses orales allant jusqu'à 100 mg/kg ont produit de faibles concentrations plasmatiques (Cmax moyenne = 92,9 ng/ml), ce qui a entraîné une biodisponibilité orale d'environ 0,03 %. La demi-vie de cet agent est estimée à environ 10 min après administration intraveineuse chez les chiens et les lapins. |
Références |
|
Informations sur lessai clinique
(données de https://clinicaltrials.gov, mis à jour le 2024-05-22)
| Numéro NCT | Recrutement | Conditions | Sponsor/Collaborateurs | Date de début | Phases |
|---|---|---|---|---|---|
| NCT03068975 | Terminated | Post Operative Ileus |
University of Puerto Rico|Merck Sharp & Dohme LLC |
September 1 2017 | Phase 4 |
| NCT00259922 | Completed | Bowel Dysfunction|Constipation |
Cubist Pharmaceuticals LLC a subsidiary of Merck & Co. Inc. (Rahway New Jersey USA)|GlaxoSmithKline |
August 2005 | Phase 3 |
| NCT00256932 | Completed | Bowel Dysfunction|Constipation |
Cubist Pharmaceuticals LLC a subsidiary of Merck & Co. Inc. (Rahway New Jersey USA)|GlaxoSmithKline |
August 2005 | Phase 3 |
| NCT00241722 | Completed | Bowel Dysfunction|Constipation |
Cubist Pharmaceuticals LLC a subsidiary of Merck & Co. Inc. (Rahway New Jersey USA)|GlaxoSmithKline |
August 1 2005 | Phase 3 |
Support technique
Tel: +1-832-582-8158 Ext:3
Si vous avez dautres questions, veuillez laisser un message.
