uitsluitend voor onderzoeksdoeleinden
Pomalidomide (CC-4047) Immunomodulerend middel
Cat.Nr.S1567
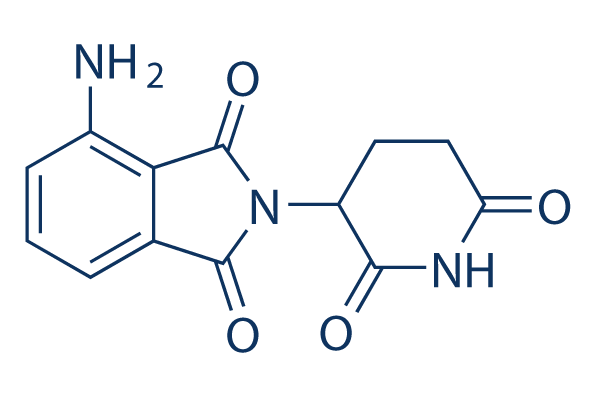
Chemische structuur
Moleculair gewicht: 273.24
Kwaliteitscontrole
| Gerelateerde doelwitten | Proteasome E1 Activating E3 Ligase DUB p97 SUMO E2 conjugating |
|---|---|
| Overige E3 ligase Ligand Inhibitoren | CC-99282 |
Celkweek, behandeling & werkconcentratie
| Cellijnen | Assaytype | Concentratie | Incubatietijd | Formulering | Activiteitsbeschrijving | PMID |
|---|---|---|---|---|---|---|
| MOLP-8 | Cytotoxicity Assay | 10 μM | 24 h | potently augments direct and indirect MM cell killing by SAR | 26338273 | |
| J-CD38 | Cytotoxicity Assay | 10 μM | 24 h | potently augments direct and indirect MM cell killing by SAR | 26338273 | |
| R-CD38 | Cytotoxicity Assay | 10 μM | 24 h | potently augments direct and indirect MM cell killing by SAR | 26338273 | |
| BC-3 | Growth Inhibition Assay | 39-1250 nM | 5 d | DMSO | IC50=107 nM, inhibits cell IC50=107 nM, viability dose dependently | 26119939 |
| BCBL-1 | Growth Inhibition Assay | 39-1250 nM | 5 d | DMSO | IC50=74 nM, inhibits cell viability dose dependently | 26119939 |
| JSC-1 | Growth Inhibition Assay | 39-1250 nM | 5 d | DMSO | IC50=34 nM, inhibits cell viability dose dependently | 26119939 |
| VG-1 | Growth Inhibition Assay | 39-1250 nM | 5 d | DMSO | IC50=101 nM, inhibits cell viability dose dependently | 26119939 |
| UMPEL-1 | Growth Inhibition Assay | 39-1250 nM | 5 d | DMSO | IC50=32 nM, inhibits cell viability dose dependently | 26119939 |
| UMPEL-3 | Growth Inhibition Assay | 39-1250 nM | 5 d | DMSO | IC50=111 nM, inhibits cell viability dose dependently | 26119939 |
| BC-1 | Growth Inhibition Assay | 39-1250 nM | 5 d | DMSO | IC50=744 nM, inhibits cell viability dose dependently | 26119939 |
| BCP-1 | Growth Inhibition Assay | 39-1250 nM | 5 d | DMSO | IC50=396 nM, inhibits cell viability dose dependently | 26119939 |
| APK-1 | Growth Inhibition Assay | 39-1250 nM | 5 d | DMSO | IC50=226 nM, inhibits cell viability dose dependently | 26119939 |
| RPMI8226 | Growth Inhibition Assay | 0.01-50 μM | 48 h | DMSO | IC50=8 μM | 26097872 |
| OPM2 | Growth Inhibition Assay | 0.01-50 μM | 48 h | DMSO | IC50=10 μM | 26097872 |
| RPMI8226 | Function Assay | 10 μM | 48 h | DMSO | strengthens cytoplasmic-nuclear shuttling of mTOR and p-mTOR protein | 26097872 |
| OPM2 | Function Assay | 10 μM | 48 h | DMSO | strengthens cytoplasmic-nuclear shuttling of mTOR and p-mTOR protein | 26097872 |
| RPMI8226 | Function Assay | 0.1-10 μM | 4 h | DMSO | increases VEGF mRNA expression | 25053990 |
| SH-SY5Y | Apoptosis Assay | 25 μg/mL | 1 h | causes statistically significant reduction in both CPF- and CPF+CM-induced apoptosis | 24975276 | |
| JJN3 | Growth Inhibition Assay | 0.1-100 μM | 72 h | DMSO | inhibits cell growth slightly | 23178378 |
| XG-1 | Growth Inhibition Assay | 0.1-100 μM | 72 h | DMSO | inhibits cell growth | 23178378 |
| CD138+ | Growth Inhibition Assay | 0.1-100 μM | 72 h | DMSO | inhibits cell growth | 23178378 |
| XG-1 | Function Assay | 2/100 μM | 24 h | DMSO | inhibits CCL3/MIP-1α mRNA expression | 23178378 |
| U266 | Growth Inhibition Assay | 0.01-10 μM | 48 h | DMSO | inhibits cell growth dose dependently | 22552008 |
| CRBN60 | Growth Inhibition Assay | 0.01-10 μM | 48 h | DMSO | inhibits cell growth dose dependently | 22552008 |
| CRNB75 | Growth Inhibition Assay | 0.01-10 μM | 48 h | DMSO | inhibits cell growth dose dependently | 22552008 |
| MM.1S | Growth Inhibition Assay | 0.01-10 μM | 48 h | DMSO | significantly inhibits proliferation at concentrations as low as 0.01μM | 21389327 |
| OPM2 | Growth Inhibition Assay | 0.01-10 μM | 48 h | DMSO | significantly inhibits proliferation at concentrations as low as 0.01μM | 21389327 |
| MM.1S | Function Assay | 10 μM | 72 h | DMSO | significantly decreases the protein level of C/EBPβ isoforms | 21389327 |
| H929 | Function Assay | 10 μM | 72 h | DMSO | significantly decreases the protein level of C/EBPβ isoforms | 21389327 |
| OPM2 | Function Assay | 10 μM | 72 h | DMSO | significantly decreases the protein level of C/EBPβ isoforms | 21389327 |
| CT26 | Function Assay | 1/10 μM | 24 h | reduces the numbers of live colonies | 19638977 | |
| T-cells | Function assay | 2 to 3 days | Inhibition of IL-2 production in human T cells measured after 2 to 3 days by ELISA, EC50 = 0.008 μM. | 23168019 | ||
| DF15 | Function assay | 4 hrs | Induction of cereblon-mediated aiolos degradation in human DF15 cells expressing ePL-tagged aiolos after 4 hrs by luminometric analysis, EC50 = 0.022 μM. | 28425720 | ||
| DF15 | Function assay | 4 hrs | Induction of cereblon-mediated ikaros degradation in human DF15 cells expressing ePL-tagged ikaros after 4 hrs by luminometric analysis, EC50 = 0.024 μM. | 28425720 | ||
| DF15 | Function assay | 4 hrs | Induction of CRL4/CRBN ubiquitin ligase-mediated aiolos degradation in human DF15 cells expressing pLOC-ePL-tagged aiolos after 4 hrs by luminescence based beta-galactosidase enzyme fragmentation complementation assay, EC50 = 0.027 μM. | 28358507 | ||
| NAMALWA | Antiproliferative assay | 72 hrs | Antiproliferative activity against human NAMALWA cells assessed as inhibition of [3H]thymidine incorporation after 72 hrs by scintillation counting, IC50 = 0.03 μM. | 23168019 | ||
| HeLa | Function assay | Inhibition of IL-1-alpha-induced NF-kappaB activation in HeLa cells assessed as blocking of p50/p65 nuclear translocation, IC50 = 1.27 μM. | 17845850 | |||
| DF15 | Function assay | 0.01 to 1 uM | 5 hrs | Induction of cereblon-mediated aiolos degradation in human DF15 cells at 0.01 to 1 uM after 5 hrs by immunoblot analysis | 28425720 | |
| OPM2 | Function assay | 0.01 to 1 uM | 5 hrs | Induction of cereblon-mediated ikaros degradation in human OPM2 cells at 0.01 to 1 uM after 5 hrs by immunoblot analysis | 28425720 | |
| DF15 | Function assay | 0.01 to 1 uM | 5 hrs | Induction of cereblon-mediated ikaros degradation in human DF15 cells at 0.01 to 1 uM after 5 hrs by immunoblot analysis | 28425720 | |
| OPM2 | Function assay | 0.01 to 1 uM | 5 hrs | Induction of cereblon-mediated aiolos degradation in human OPM2 cells at 0.01 to 1 uM after 5 hrs by immunoblot analysis | 28425720 | |
| Klik om meer experimentele gegevens over de cellijn te bekijken | ||||||
Chemische informatie, Opslag en Stabiliteit
| Moleculair gewicht | 273.24 | Formule | C13H11N3O4 |
Opslag (Vanaf de ontvangstdatum) | |
|---|---|---|---|---|---|
| CAS-nr. | 19171-19-8 | SDF downloaden | Opslag van stamoplossingen |
|
|
| Synoniemen | CC-4047 | Smiles | C1CC(=O)NC(=O)C1N2C(=O)C3=C(C2=O)C(=CC=C3)N | ||
Oplosbaarheid
|
In vitro |
DMSO
: 100 mg/mL
(365.97 mM)
Water : Insoluble Ethanol : Insoluble |
Molariteitscalculator
|
In vivo |
|||||
In vivo Formuleringscalculator (Heldere oplossing)
Stap 1: Voer de onderstaande informatie in (Aanbevolen: Een extra dier voor het geval van verlies tijdens het experiment)
Stap 2: Voer de in vivo formulering in (Dit is alleen de calculator, geen formulering. Neem eerst contact met ons op als er geen in vivo formulering is in het gedeelte Oplosbaarheid.)
Berekeningsresultaten:
Werkconcentratie: mg/ml;
Methode voor het bereiden van DMSO-mastervloeistof: mg geneesmiddel vooraf opgelost in μL DMSO ( Concentratie mastervloeistof mg/mL, Neem eerst contact met ons op als de concentratie de DMSO-oplosbaarheid van de partij geneesmiddel overschrijdt. )
Methode voor het bereiden van in vivo formulering: Neem μL DMSO mastervloeistof, voeg vervolgens toeμL PEG300, mengen en helder maken, voeg vervolgens toeμL Tween 80, mengen en helder maken, voeg vervolgens toe μL ddH2O, mengen en helder maken.
Methode voor het bereiden van in vivo formulering: Neem μL DMSO mastervloeistof, voeg vervolgens toe μL Maïsolie, mengen en helder maken.
Opmerking: 1. Zorg ervoor dat de vloeistof helder is voordat u het volgende oplosmiddel toevoegt.
2. Zorg ervoor dat u het/de oplosmiddel(en) in de juiste volgorde toevoegt. U moet ervoor zorgen dat de verkregen oplossing, bij de vorige toevoeging, een heldere oplossing is voordat u verdergaat met het toevoegen van het volgende oplosmiddel. Fysische methoden zoals vortexen, echografie of een warmwaterbad kunnen worden gebruikt om het oplossen te bevorderen.
Werkingsmechanisme
| Kenmerken |
A derivative of thalidomide and up to 10,000 times more potent than thalidomide.
|
|---|---|
| Targets/IC50/Ki |
CRBN
TNF-α
(PBMCs) 13 nM
|
| In vitro |
Pomalidomide remt de lipopolysaccharide (LPS) gestimuleerde TNF-alpha-afgifte in menselijke PBMC en in menselijk volbloed met IC50-waarden van respectievelijk 13 nM en 25 nM. Deze verbinding remt de groei van T-regulerende cellen, die wordt gestimuleerd door IL-2 met een IC50 van ~1 μM. Behandeling met dit chemische middel (6,4 nM-10 μM) verhoogt de productie van IL-2 in menselijke perifere bloed-T-cellen, en is iets potenter in de CD4+-subpopulatie dan in de CD8+-subpopulatie. Het is significant potenter dan CC-5013 in het verhogen van IL-2-, IL-5- en IL-10-niveaus, maar slechts iets potenter dan CC-5013 in het verhogen van IFN-γ-niveaus. Dit middel verhoogt de SEE- en Raji-cellen-geïnduceerde AP-1-transcriptieactiviteit in Jurkat-cellen op een dosisafhankelijke manier, met een maximale verhoging van 4-voudig bij 1 μM. Blootstelling van Raji-cellen aan verschillende concentraties van deze verbinding (2,5-40 μg/mL) gedurende 48 uur leidt tot een significante afname van celproliferatie en DNA-synthese. Er is een reductie van ~40% vergeleken met met vehikel behandelde controles. |
| Kinase Assay |
Remming van TNF-α-synthese
|
|
TNF-α-remmende activiteit wordt gemeten in met lipopolysacharide (LPS) gestimuleerde PBMC. Pomalidomide wordt 1 uur voorafgaand aan de toevoeging van LPS (1 μg/mL) aan menselijke PBMC's toegevoegd en de incubatie wordt voortgezet gedurende nog eens 18-20 uur. Supernatanten worden vervolgens geoogst en de concentratie van TNF-α in de supernatanten wordt bepaald door ELISA. De concentratie van deze verbinding die de TNF-productie met 50% (IC50) remt, wordt berekend door niet-lineaire regressieanalyse. De humane volbloed TNF-remmingsassay wordt op een vergelijkbare manier uitgevoerd als de PBMC-assay, behalve dat gehepariniseerd vers menselijk volbloed direct in microtiterplaten wordt uitgeplaat.
|
|
| In vivo |
Pomalidomide versterkt het antitumorale effect van rituximab tegen B-cellymfomen in ernstig gecombineerde immunodeficiënte muizen. Toediening van deze verbinding in combinatie met rituximab geeft de muizen een mediane overlevingsperiode van 74 dagen vergeleken met 58 dagen van CC5013/rituximab-behandeling en 45 dagen van rituximab-monotherapie. Het synergistische effect van deze verbinding en rituximab kan volledig worden opgeheven door depletie van NK-cellen, wat de bewering ondersteunt dat NK-celuitbreiding een mechanisme is waarmee deze verbinding de antitumorale activiteit van rituximab kan versterken. |
Referenties |
|
Toepassingen
| Methoden | Biomarkers | Afbeeldingen | PMID |
|---|---|---|---|
| Western blot | CEBPβ IKZF1 / IKZF3 / UBE2G1 / CRBN |
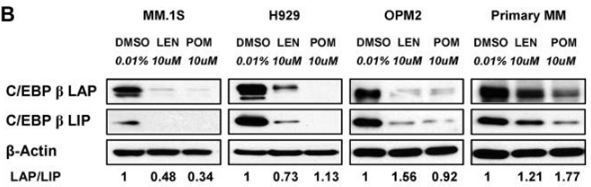
|
21389327 |
| Immunofluorescence | IKZF1 |
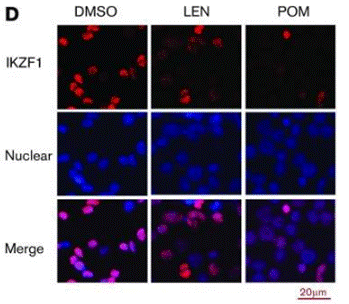
|
29496670 |
Informatie klinische proef
(gegevens van https://clinicaltrials.gov, bijgewerkt op 2024-05-22)
| NCT-nummer | Rekrutering | Aandoeningen | Sponsor/Medewerkers | Startdatum | Fasen |
|---|---|---|---|---|---|
| NCT04902443 | Recruiting | Viral Associated Malignancies|Kaposi Sarcoma|EBV/KSHV-associated Lymphomas |
National Cancer Institute (NCI)|National Institutes of Health Clinical Center (CC) |
December 10 2021 | Phase 1 |
Technische ondersteuning
Tel: +1-832-582-8158 Ext:3
Als u nog andere vragen heeft, kunt u een bericht achterlaten.
Veelgestelde vragen
Vraag 1:
Is the formulation S1567 in 1% DMSO+30% polyethylene glycol+1% Tween 80 suitable for its oral administration?
Antwoord:
Its suspension in 1% DMSO+30% polyethylene glycol+1% Tween 80 is for oral gavage.
Vraag 2:
I would like to know if it is racemic or optically active?
Antwoord:
Our S1567 is racemic.
