Technische Daten
| Formel | C12H14N4O3.HCl |
|||
| Molekulargewicht | 298.73 | CAS-Nr. | 120964-45-6 | |
| Löslichkeit (25°C)* | In vitro | DMSO | 60 mg/mL (200.85 mM) | |
| Water | 60 mg/mL (200.85 mM) | |||
| Ethanol | Insoluble | |||
|
* <1 mg/ml bedeutet schwer löslich oder unlöslich. * Bitte beachten Sie, dass Selleck die Löslichkeit aller Verbindungen intern testet und die tatsächliche Löslichkeit geringfügig von veröffentlichten Werten abweichen kann. Dies ist normal und ist auf geringfügige Batch-zu-Batch-Variationen zurückzuführen. * Versand bei Raumtemperatur (Stabilitätstests zeigen, dass dieses Produkt ohne Kühlmaßnahmen versendet werden kann.) |
||||
Vorbereitung von Stammlösungen
Biologische Aktivität
| Beschreibung | DZNeP (3-Deazaneplanocin A) HCl, ein Adenosin-Analogon, ist ein kompetitiver Inhibitor der S-Adenosylhomocystein-Hydrolase mit einem Ki von 50 pM in einem zellfreien Assay. | ||
|---|---|---|---|
| Ziele |
|
||
| In vitro | 3-Deazaneplanocin A (DZNep) Hydrochloride (1,0 μM) führt zu einer signifikanten Zunahme der Akkumulation von Zellen in der G0/G1-Phase (58,5 %) bei gleichzeitiger Abnahme der Anzahl von Zellen in der S-Phase (35,2 %) und den G2/M-Phasen (6,3 %) des Zellzyklus von OCI-AML3-Zellen der akuten myeloischen Leukämie beim Menschen. Es induziert Apoptose in OCI-AML3- (~50 %) und HL-60-Zellen (~50 %) und eine mehr als 90-prozentige Verringerung des Koloniewachstums nach 48 Stunden. Es senkt die EZH2-Spiegel und hemmt die Trimethylierung von Lysin 27 auf Histon H3 in den HL-60- und OCI-AML3-Zellen sowie in primären AML-Zellen. Die Behandlung mit dem Wirkstoff induziert p16, p21, p27 und FBXO32 und senkt gleichzeitig die Cyclin-E- und HOXA9-Spiegel. 500 nM 3-Deazaneplanocin A induzieren die Differenzierung von HL-60 zu CD11b+-Zellen um fast das Dreifache nach 48 Stunden. Das Alkaloid zeigt zudem eine ausgezeichnete Wirksamkeit gegen mehrere Virustypen. Es wirkt gegen vesikuläre Stomatitis in L929-Zellen, Parainfluenza 3 in H.Ep-2 sowie Vaccinia- und Gelbfieberviren in Vero-Zellen mit einer IC50 von 0,2, 3,6, 2,1 bzw. 2,9 μg/ml. In der Studie zeigt es eine starke und gleichmäßige leishmanostatische Wirkung auf amerikanische Leishmania-Stämme (L. mexicana und L. brasiliensis) mit einer durchschnittlichen ID50 von 96 ng/ml, hemmt jedoch nicht die verschiedenen getesteten T. cruzi- und T. rangeli-Stämme bei Konzentrationen von bis zu 10 μg/ml. Bei einer Dosis von 200 ng/ml hemmt es nach vier Tagen die Einlagerung von S-Adenosyl-L-3H-Methylmethionin und 3-Thymidin durch Promastigoten. Bei einer Dosis von 100 ng/ml eliminiert es etwa 56 % der L. mexicana und L. brasiliensis aus infizierten menschlichen Makrophagen. |
||
| In vivo | Es zeigt in vivo eine antileukämische Wirkung. In einer Dosierung von 8 mg/kg zeigt es in vivo eine antivirale Wirkung gegen das Vaccinia-Virus in einem Maus-Schwanzpocken-Test mit einem Medianwert von 0,0 poxftail (84 % Schutz). In Dosen von 0,5 bis 1,5 mg/kg/Tag reduzierte es signifikant die Entwicklung einer kutanen Leishmaniose-Infektion, die bei Inzucht-BALB/c-Mäusen durch Inokulation mit L. b. guyanensis hervorgerufen wurde. Es induziert eine massiv erhöhte Interferon-α-Produktion in mit dem Ebola-Virus infizierten Mäusen. Eine subkutane Injektion von 2 mg/kg nach der Infektion verhindert den Tod von Mäusen, die mit 1000 pfu (30 000 LD50) des an Mäuse angepassten EBO-Z infiziert wurden. Die Behandlung mit dem Wirkstoff am Tag 1 reduziert die mittleren Serumvirustiter am Tag 2 um das 100-Fache und am Tag 3 um das 100 000-Fache im Vergleich zu Placebo-Kontrollen und führt zu einem mittleren Serum-IFN-α-Spiegel von 1420 pg/ml am Tag 2 und 1830 pg/ml am Tag 3. |
||
| Merkmale | Karbocyclisches Analogon von Adenosin, wirkt als Antitumor- und Antivirus-Inhibitor von EZH2. |
Protokoll (aus Referenz)
| Kinase-Assay: |
|
|---|---|
| Zell-Assay: |
|
| Tierstudie: |
|
Referenzen
|
Kundenproduktvalidierung
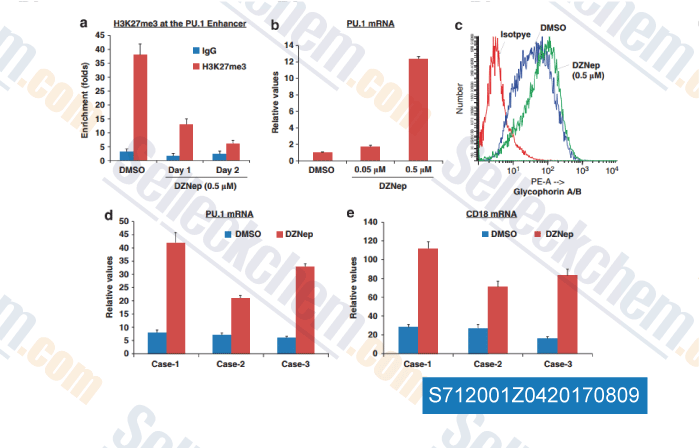
-
Daten von [ , , Leukemia, 2013, 1291-1300 ]
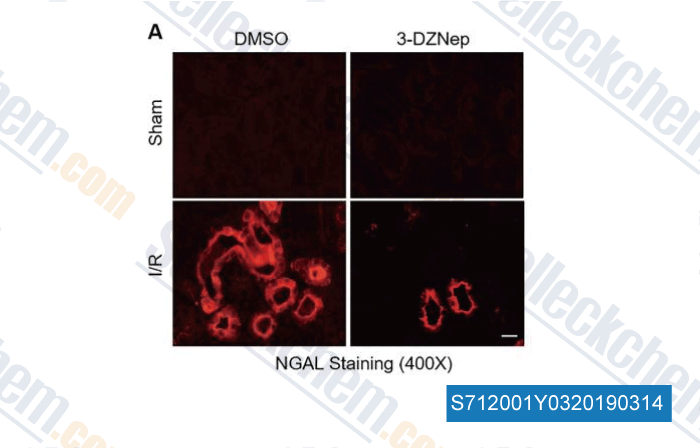
-
Daten von [ , , Cell Death Dis, 2018, 9(11):1067 ]
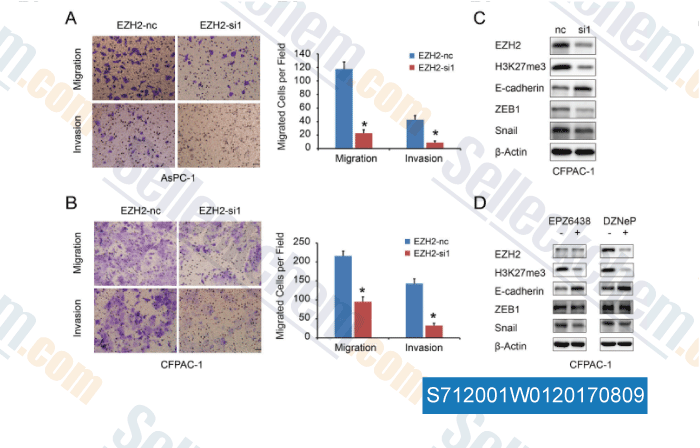
-
Daten von [ , , Oncotarget, 2016, 7(10):11194-207 ]
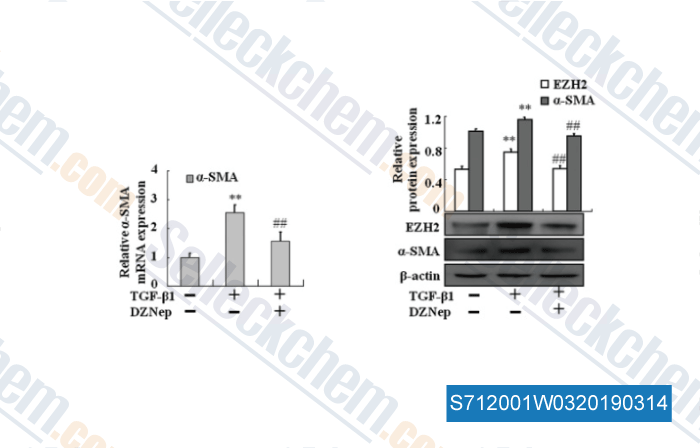
-
Daten von [ , , J Cell Mol Med, 2017, 21(10):2317-2328 ]
Sellecks 3-Deazaneplanocin A (DZNep) Hydrochloride Wurde zitiert von 97 Publikationen
| Atlas of amnion development during the first trimester of human pregnancy [ Nat Cell Biol, 2025, 27(7):1175-1185] | PubMed: 40659869 |
| LINE1 elements at distal junctions of rDNA repeats regulate nucleolar organization in human embryonic stem cells [ Genes Dev, 2025, 39(3-4):280-298] | PubMed: 39797762 |
| Breaking the link between morphology and potency for mESCs [ Cell Biosci, 2025, 15(1):146] | PubMed: 41131638 |
| [C6TSEDRVAJZ, a combination of small-molecule compounds, induces differentiation of human placental fibroblasts into epithelioid cells in vitro] [ Nan Fang Yi Ke Da Xue Xue Bao, 2025, 45(2):322-330] | PubMed: 40031976 |
| Epigenetic modifiers to treat retinal degenerative diseases [ bioRxiv, 2025, 2025.05.22.655558] | PubMed: 40501782 |
| Key epigenetic and signaling factors in the formation and maintenance of the blood-brain barrier [ Elife, 2024, 12RP86978] | PubMed: 39670988 |
| Transposable element activity captures human pluripotent cell states [ EMBO Rep, 2024, 10.1038/s44319-024-00343-y] | PubMed: 39668246 |
| Enhancer of Zeste Homolog 2 Inhibition Induces HLA Class I Re-Expression in Merkel Cell Carcinoma [ J Invest Dermatol, 2024, 144(6):1398-1401.e1.] | PubMed: 38052265 |
| Perinuclear assembly of vimentin intermediate filaments induces cancer cell nuclear dysmorphia [ J Biol Chem, 2024, 300(12):107981] | PubMed: 39542246 |
| Activation of the CCL22/CCR4 causing EMT process remodeling under EZH2-mediated epigenetic regulation in cervical carcinoma [ J Cancer, 2024, 15(19):6299-6314] | PubMed: 39513112 |
RÜCKGABERICHTLINIE
Die bedingungslose Rückgaberichtlinie von Selleck Chemical gewährleistet unseren Kunden ein reibungsloses Online-Einkaufserlebnis. Wenn Sie in irgendeiner Weise mit Ihrem Kauf unzufrieden sind, können Sie jeden Artikel innerhalb von 7 Tagen nach Erhalt zurückgeben. Im Falle von Produktqualitätsproblemen, sei es protokollbezogene oder produktbezogene Probleme, können Sie jeden Artikel innerhalb von 365 Tagen ab dem ursprünglichen Kaufdatum zurückgeben. Bitte befolgen Sie die nachstehenden Anweisungen, wenn Sie Produkte zurücksenden.
VERSAND UND LAGERUNG
Selleck-Produkte werden bei Raumtemperatur transportiert. Wenn Sie das Produkt bei Raumtemperatur erhalten, seien Sie versichert, dass die Qualitätskontrollabteilung von Selleck Experimente durchgeführt hat, um zu überprüfen, dass die normale Temperaturplatzierung von einem Monat die biologische Aktivität von Pulverprodukten nicht beeinträchtigt. Nach dem Sammeln lagern Sie das Produkt bitte gemäß den in der Datenblatt beschriebenen Anforderungen. Die meisten Selleck-Produkte sind unter den empfohlenen Bedingungen stabil.
NICHT FÜR DIE ANWENDUNG AM MENSCHEN, FÜR VETERINÄRMEDIZINISCHE DIAGNOSTIK ODER THERAPEUTISCHE ZWECKE.
