Technische Daten
| Formel | C25H26ClN5O3 |
||||||
| Molekulargewicht | 479.96 | CAS-Nr. | 468740-43-4 | ||||
| Löslichkeit (25°C)* | In vitro | DMSO | 96 mg/mL (200.01 mM) | ||||
| Water | Insoluble | ||||||
| Ethanol | Insoluble | ||||||
| In vivo (Lösungsmittel einzeln und der Reihe nach zum Produkt hinzufügen.) |
|
||||||
|
* <1 mg/ml bedeutet schwer löslich oder unlöslich. * Bitte beachten Sie, dass Selleck die Löslichkeit aller Verbindungen intern testet und die tatsächliche Löslichkeit geringfügig von veröffentlichten Werten abweichen kann. Dies ist normal und ist auf geringfügige Batch-zu-Batch-Variationen zurückzuführen. * Versand bei Raumtemperatur (Stabilitätstests zeigen, dass dieses Produkt ohne Kühlmaßnahmen versendet werden kann.) |
|||||||
Vorbereitung von Stammlösungen
Biologische Aktivität
| Beschreibung | BMS-536924 (CS-0117) ist ein ATP-kompetitiver IGF-1R/IR-Inhibitor mit einer IC50 von 100 nM/73 nM, moderater Aktivität für Mek, Fak und Lck und sehr geringer Aktivität für Akt1, MAPK1/2. | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Ziele |
|
|||||||||||
| In vitro | BMS-536924 hemmt auch FAK und Lck mit einer IC50 von 150 nM bzw. 341 nM. Diese Verbindung hemmt die Zellproliferation und stört die Akt- und MAPK-Phosphorylierung. Sie hemmt die IGF-I-stimulierte IGF-1R-Signalgebung in MCF10A-Zellen und blockiert die konstitutive IGF-1R-Aktivität in CD8-IGF-1R-MCF10A. Die Präinkubation von MCF10A-Zellen mit 1 μM dieser Chemikalie blockiert vollständig die Fähigkeit von IGF-I, die IGF-1R-Phosphorylierung zu stimulieren. Die IGF-I-Stimulation führt zu einer erhöhten Phosphorylierung von ERK1/2, GSK3β und Akt. Diese Verbindung hemmt diese Liganden-induzierte Phosphorylierung. Die Behandlung der CD8-IGF-1R-MCF10A-Zellen mit diesem Inhibitor führt zu einer dosisabhängigen Hemmung der Phosphorylierung mit partieller Hemmung bei 0,01 μM und 0,1 μM, aber vollständiger Rezeptorhemmung bei einer Konzentration von 1 μM. Die maximale Hemmung des phosphorylierten IGF-1R wird bereits nach 10 Minuten Inkubation beobachtet. Es behält seine Fähigkeit, die IGF-1R-Phosphorylierung für bis zu 48 Stunden zu hemmen. Die Zugabe dieses Agens hemmt die Akt-Phosphorylierung zeitabhängig, beginnend nach 1 Stunde. Nach 48 Stunden ist die Akt-Aktivierung vollständig blockiert. Die Behandlung mit dieser Verbindung zeigt eine antiproliferative Aktivität in einer Reihe von Krebszelllinien, einschließlich TC32-, HT1080/S-, SK-LMS-1-, H513- und CTR-Zellen. pIGF-1R/pIR wird nach IGF-I/Insulin-Stimulation aktiviert und die Aktivierung wird durch diese Chemikalie mit ähnlichen Potenzen in Rh41- und Rh36-Zelllinien gehemmt. Die Expression von programmed cell death 4 (PDCD4), die Spaltung von Poly(ADP-Ribose)-Polymerase (PARP) und Caspase-3 sind in Rh41-Zellen, die mit diesem Inhibitor behandelt wurden, hochreguliert. | |||||||||||
| In vivo | Die orale Verabreichung von BMS-536924 bei 100-300 mg/kg hemmt das IGR-1R Sal Tumormodell stark. Eine Wirksamkeit wird auch im nicht-genmanipulierten Colo205 humanen Dickdarmkarzinommodell beobachtet. Die orale Verabreichung dieser Verbindung einmal täglich (100-300 mg/kg) oder zweimal täglich (50, 100 mg/kg) zeigt Antitumoraktivität in diesem Tumormodell. Der orale Glukosetoleranztest (OGTT) zeigt, dass 100 mg/kg (zweimal täglich) nach einer Glukosebelastung einen signifikanten Anstieg der Glukosespiegel verursacht. Die pharmakokinetischen Parameter dieser Chemikalie, die oral in Poly(ethylenglykol) 400 und Wasser (80:20 v/v) verabreicht wurde, wurden in Maus, Ratte, Hund und Affe bestimmt. Eine gute Bioverfügbarkeit war in allen Spezies offensichtlich. Eine signifikante nichtlineare Pharmakokinetik wurde bei Nagetieren mit zunehmender oraler Dosis beobachtet. Diese Verbindung reduziert das Tumorxenograftvolumen von CD8-IGF-1R-MCF10A-Zellen nach zweiwöchiger Behandlung (100 mg/kg) auf 76 %. Die orale Verabreichung von 70 mg/kg dieser Chemikalie hemmt das Tumorwachstum (TGBC-1TKB-Zellen), die in Nacktmäuse inokuliert wurden, signifikant. Es reguliert die Apoptose in Xenograft-Tumoren hoch. Die Behandlung hatte keine nachteiligen Auswirkungen auf das Körpergewicht der Mäuse oder die Glukosespiegel zum Zeitpunkt des Todes, was auf eine tolerierbare Toxizität hindeutet. |
Protokoll (aus Referenz)
| Kinase-Assay: |
|
|---|---|
| Zell-Assay: |
|
| Tierstudie: |
|
Referenzen
|
Kundenproduktvalidierung
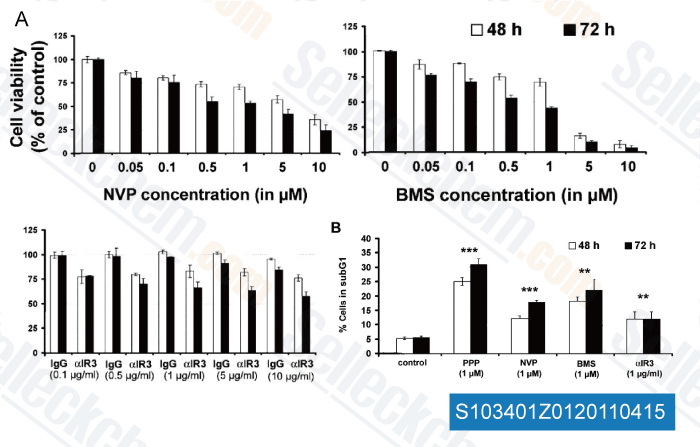
-
Daten von [ Clin Cancer Res , 2011 , 17, 2237-2249 ]
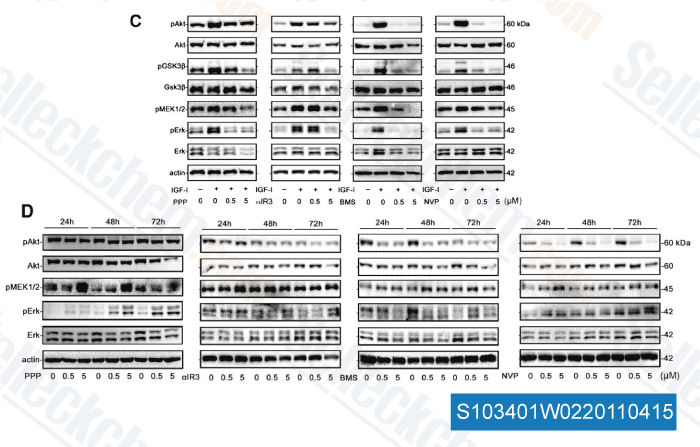
-
Daten von [ Clin Cancer Res , 2011 , 17, 2237-2249 ]
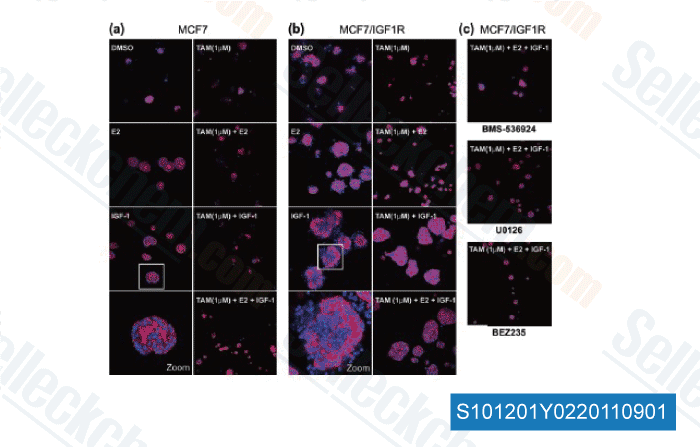
-
Daten von [ Breast Cancer Res , 2011 , 13, R52 ]
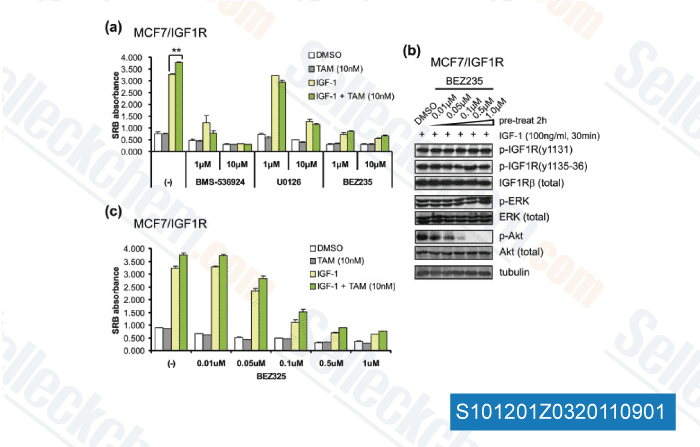
-
Daten von [ Breast Cancer Res , 2011 , 13, R52 ]
Sellecks BMS-536924 Wurde zitiert von 27 Publikationen
| Haploinsufficiency of miR-143 and miR-145 reveal targetable dependencies in resistant del(5q) myelodysplastic neoplasm [ Leukemia, 2025, 39(4):917-928] | PubMed: 40000845 |
| Inhibition of Selenoprotein I promotes ferroptosis and reverses resistance to platinum chemotherapy by impairing Akt phosphorylation in ovarian cancer [ MedComm (2020), 2024, 5(12):e70033] | PubMed: 39669976 |
| High-Content and High-Throughput Clonogenic Survival Assay Using Fluorescence Barcoding [ Cancers -Basel), 2023, 15(19)4772] | PubMed: 37835466 |
| SFRP4+ stromal cell subpopulation with IGF1 signaling in human endometrial regeneration [ Cell Discov, 2022, 8(1):95] | PubMed: 36163341 |
| Multi-omics characterization of autophagy-related molecular features for therapeutic targeting of autophagy [ Nat Commun, 2022, 13(1):6345] | PubMed: 36289218 |
| FER-mediated phosphorylation and PIK3R2 recruitment on IRS4 promotes AKT activation and tumorigenesis in ovarian cancer cells [ Elife, 2022, 11e76183] | PubMed: 35550247 |
| Exosomes from cisplatin-induced dormant cancer cells facilitate the formation of premetastatic niche in bone marrow through activating glycolysis of BMSCs [ Front Oncol, 2022, 12:922465] | PubMed: 36568212 |
| Intermittent parathyroid hormone improves orthodontic retention via insulin-like growth factor-1 [ Oral Dis, 2021, 27(2):290-300] | PubMed: 32608117 |
| Manganese Acts upon Insulin/IGF Receptors to Phosphorylate AKT and Increase Glucose Uptake in Huntington's Disease Cells [ Mol Neurobiol, 2020, 57(3):1570-1593] | PubMed: 31797328 |
| Loss of N-Glycanase 1 Alters Transcriptional and Translational Regulation in K562 Cell Lines [ G3 (Bethesda), 2020, 4;10(5):1585-1597] | PubMed: 32265286 |
RÜCKGABERICHTLINIE
Die bedingungslose Rückgaberichtlinie von Selleck Chemical gewährleistet unseren Kunden ein reibungsloses Online-Einkaufserlebnis. Wenn Sie in irgendeiner Weise mit Ihrem Kauf unzufrieden sind, können Sie jeden Artikel innerhalb von 7 Tagen nach Erhalt zurückgeben. Im Falle von Produktqualitätsproblemen, sei es protokollbezogene oder produktbezogene Probleme, können Sie jeden Artikel innerhalb von 365 Tagen ab dem ursprünglichen Kaufdatum zurückgeben. Bitte befolgen Sie die nachstehenden Anweisungen, wenn Sie Produkte zurücksenden.
VERSAND UND LAGERUNG
Selleck-Produkte werden bei Raumtemperatur transportiert. Wenn Sie das Produkt bei Raumtemperatur erhalten, seien Sie versichert, dass die Qualitätskontrollabteilung von Selleck Experimente durchgeführt hat, um zu überprüfen, dass die normale Temperaturplatzierung von einem Monat die biologische Aktivität von Pulverprodukten nicht beeinträchtigt. Nach dem Sammeln lagern Sie das Produkt bitte gemäß den in der Datenblatt beschriebenen Anforderungen. Die meisten Selleck-Produkte sind unter den empfohlenen Bedingungen stabil.
NICHT FÜR DIE ANWENDUNG AM MENSCHEN, FÜR VETERINÄRMEDIZINISCHE DIAGNOSTIK ODER THERAPEUTISCHE ZWECKE.
