Technische Daten
| Formel | C21H21FN6O |
||||||||||
| Molekulargewicht | 392.43 | CAS-Nr. | 405169-16-6 | ||||||||
| Löslichkeit (25°C)* | In vitro | DMSO | 30 mg/mL (76.44 mM) | ||||||||
| Water | Insoluble | ||||||||||
| Ethanol | Insoluble | ||||||||||
| In vivo (Lösungsmittel einzeln und der Reihe nach zum Produkt hinzufügen.) |
|
||||||||||
|
* <1 mg/ml bedeutet schwer löslich oder unlöslich. * Bitte beachten Sie, dass Selleck die Löslichkeit aller Verbindungen intern testet und die tatsächliche Löslichkeit geringfügig von veröffentlichten Werten abweichen kann. Dies ist normal und ist auf geringfügige Batch-zu-Batch-Variationen zurückzuführen. * Versand bei Raumtemperatur (Stabilitätstests zeigen, dass dieses Produkt ohne Kühlmaßnahmen versendet werden kann.) |
|||||||||||
Vorbereitung von Stammlösungen
Biologische Aktivität
| Beschreibung | Dovitinib (TKI-258, CHIR258) ist ein Multitarget-RTK-Inhibitor, der primär auf Klasse III RTKs (FLT3/c-Kit) mit IC50-Werten von 1 nM/2 nM abzielt. Er ist auch wirksam gegen Klasse IV (FGFR1/3) und Klasse V (VEGFR1-4) RTKs mit IC50-Werten von 8–13 nM, während er in zellfreien Assays eine geringere Wirksamkeit gegenüber InsR, EGFR, c-Met, EphA2, Tie2, IGF-1R und HER2 zeigt. Phase 4. | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Ziele |
|
|||||||||||
| In vitro | Dovitinib (TKI-258) hemmt stark das FGF-stimulierte Wachstum von WT- und F384L-FGFR3-exprimierenden B9-Zellen mit einer IC50 von 25 nM. Darüber hinaus hemmt es die Proliferation von B9-Zellen, die jeweils die verschiedenen aktivierten Mutanten von FGFR3 exprimieren. Interessanterweise wurden minimale Unterschiede in der Empfindlichkeit der verschiedenen FGFR3-Mutationen gegenüber dieser Verbindung beobachtet, wobei die IC50 für jede der verschiedenen Mutationen zwischen 70 und 90 nM lag. IL-6-abhängige B9-Zellen, die nur Vektor enthalten (B9-MINV-Zellen), sind resistent gegenüber seiner hemmenden Aktivität bei Konzentrationen bis zu 1 μM. Es hemmt die Zellproliferation von KMS11 (FGFR3-Y373C), OPM2 (FGFR3-K650E) und KMS18 (FGFR3-G384D)-Zellen mit einer IC50 von 90 nM (KMS11 und OPM2) bzw. 550 nM. Die Verbindung hemmt die FGF-vermittelte ERK1/2-Phosphorylierung und induziert Zytotoxizität in FGFR3-exprimierenden primären MM-Zellen. BMSCs verleihen einen moderaten Grad an Resistenz mit 44,6 % Wachstumshemmung für Zellen, die mit 500 nM Dovitinib behandelt und auf Stroma kultiviert wurden, verglichen mit 71,6 % Wachstumshemmung für Zellen, die ohne BMSCs gezüchtet wurden. Es hemmt die Proliferation von M-NFS-60, einer M-CSF-Wachstums-gesteuerten murinen myeloblastischen Zelllinie mit einer mittleren effektiven Konzentration (EC50) von 220 nM. Die Behandlung von SK-HEP1-Zellen mit dieser Verbindung führt zu einer dosisabhängigen Reduktion der Zellzahl und einem G2/M-Phasenarrest mit Reduktion der G0/G1- und S-Phasen, Hemmung des Verankerungs-unabhängigen Wachstums und Blockade der bFGF-induzierten Zellmotilität. Die IC50 dafür in SK-HEP1-Zellen beträgt ungefähr 1,7 μM. Es reduziert auch signifikant die basalen Phosphorylierungsniveaus von FGFR-1, FGFR substrate 2α (FRS2-α) und ERK1/2, aber nicht Akt in sowohl SK-HEP1- als auch 21-0208-Zellen. In 21-0208 HCC-Zellen hemmt es signifikant die bFGF-induzierte Phosphorylierung von FGFR-1, FRS2-α, ERK1/2, aber nicht Akt. |
|||||||||||
| In vivo | Dovitinib (TKI-258) induziert in vivo sowohl zytostatische als auch zytotoxische Reaktionen, die zu einer Regression von FGFR3-exprimierenden Tumoren führen. Es zeigt eine dosis- und expositionsabhängige Hemmung von Ziel-Rezeptor-Tyrosinkinasen (RTKs), die in Tumorxenotransplantaten exprimiert werden. Diese Verbindung hemmt stark das Tumorwachstum von sechs HCC-Linien. Die Hemmung der Angiogenesis korrelierte mit der Inaktivierung der FGFR/PDGFRβ/VEGFR2-Signalwege. In einem orthotopen Modell hemmt es stark das primäre Tumorwachstum und die Lungenmetastasierung und verlängerte signifikant das Überleben der Mäuse. Die Verabreichung von Dovitinib führt zu einer signifikanten Tumorwachstumshemmung und Tumorrückbildung, einschließlich großer, etablierter Tumoren (500-1.000 mm3). |
Protokoll (aus Referenz)
| Kinase-Assay: |
|
|---|---|
| Zell-Assay: |
|
| Tierstudie: |
|
Referenzen
|
Kundenproduktvalidierung
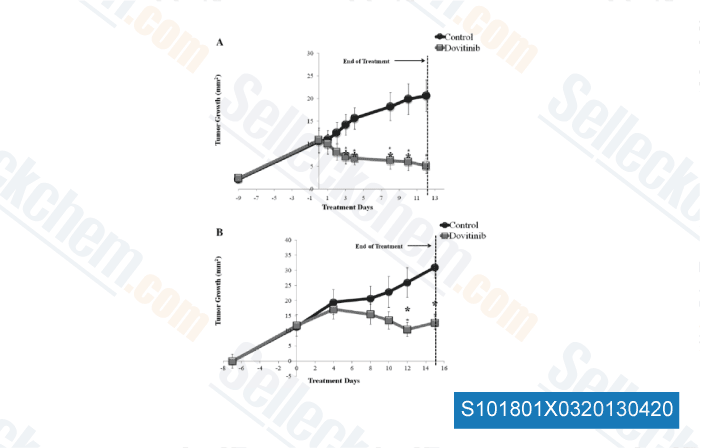
-
Daten von [ Oral Oncol , 2012 , 48, 1242-9 ]
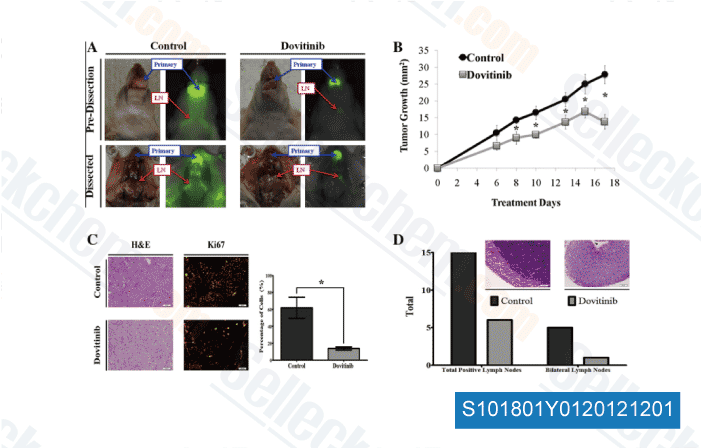
-
Daten von [ Oral Oncol , 2012 , 48, 1242-9 ]
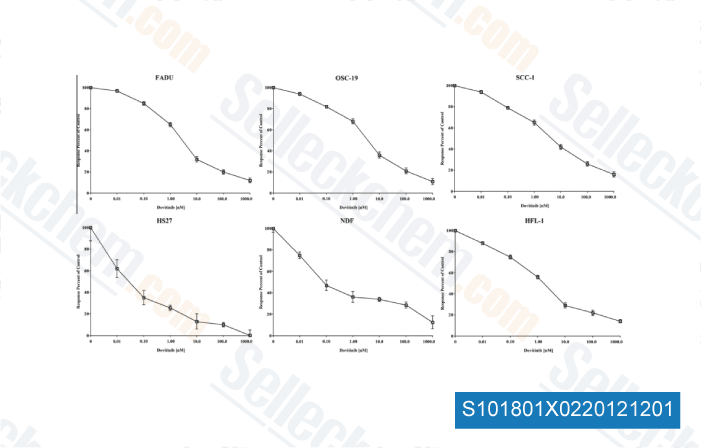
-
Daten von [ Oral Oncol , 2012 , 48, 1242-9 ]
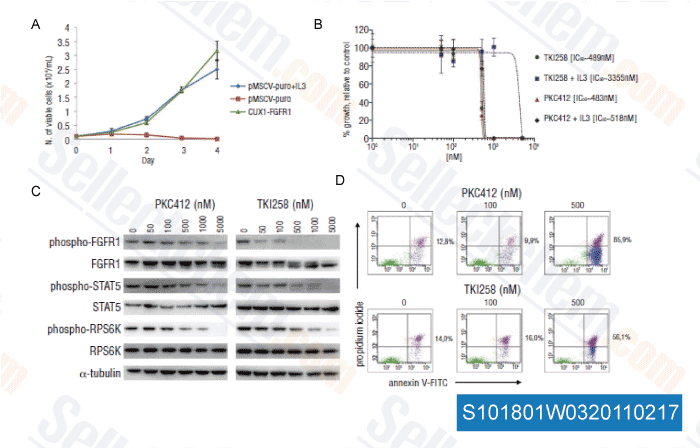
-
Daten von [ Haematologica , 2011 , 96, 922-926 ]
Sellecks Dovitinib (TKI-258) Wurde zitiert von 54 Publikationen
| Characterization of dovitinib-human serum albumin association potential through optical spectroscopic and in silico approaches [ Spectrochim Acta A Mol Biomol Spectrosc, 2025, 343:126602] | PubMed: 40582029 |
| Sensitizing cholangiocarcinoma to chemotherapy by inhibition of the drug-export pump MRP3 [ Biomed Pharmacother, 2024, 180:117533] | PubMed: 39405909 |
| Efficacy of futibatinib, an irreversible fibroblast growth factor receptor inhibitor, in FGFR-altered breast cancer [ Sci Rep, 2023, 13(1):20223] | PubMed: 37980453 |
| CREB3L2-ATF4 heterodimerization defines a transcriptional hub of Alzheimer's disease gene expression linked to neuropathology [ Sci Adv, 2023, 9(9):eadd2671] | PubMed: 36867706 |
| Efeito do tratamento TKI-258 sobre a expressão gênica de seus receptores-alvo e ativação de suas efetoras GTPases Rho em carcinoma epidermoide oral in vitro. [ UFTM, 2023, ] | PubMed: none |
| A community challenge for a pancancer drug mechanism of action inference from perturbational profile data [ Cell Rep Med, 2022, 3(1):100492] | PubMed: 35106508 |
| EGFR-phosphorylated GDH1 harmonizes with RSK2 to drive CREB activation and tumor metastasis in EGFR-activated lung cancer [ Cell Rep, 2022, 41(11):111827] | PubMed: 36516759 |
| Comprehensive drug response profiling and pan-omic analysis identified therapeutic candidates and prognostic biomarkers for Asian cholangiocarcinoma [ iScience, 2022, 25(10):105182] | PubMed: 36248745 |
| Lysine acetylation restricts mutant IDH2 activity to optimize transformation in AML cells [ Mol Cell, 2021, S1097-2765(21)00507-4] | PubMed: 34289383 |
| Targeting fibroblast growth factor receptors to combat aggressive ependymoma [ Acta Neuropathol, 2021, 10.1007/s00401-021-02327-x] | PubMed: 34046693 |
RÜCKGABERICHTLINIE
Die bedingungslose Rückgaberichtlinie von Selleck Chemical gewährleistet unseren Kunden ein reibungsloses Online-Einkaufserlebnis. Wenn Sie in irgendeiner Weise mit Ihrem Kauf unzufrieden sind, können Sie jeden Artikel innerhalb von 7 Tagen nach Erhalt zurückgeben. Im Falle von Produktqualitätsproblemen, sei es protokollbezogene oder produktbezogene Probleme, können Sie jeden Artikel innerhalb von 365 Tagen ab dem ursprünglichen Kaufdatum zurückgeben. Bitte befolgen Sie die nachstehenden Anweisungen, wenn Sie Produkte zurücksenden.
VERSAND UND LAGERUNG
Selleck-Produkte werden bei Raumtemperatur transportiert. Wenn Sie das Produkt bei Raumtemperatur erhalten, seien Sie versichert, dass die Qualitätskontrollabteilung von Selleck Experimente durchgeführt hat, um zu überprüfen, dass die normale Temperaturplatzierung von einem Monat die biologische Aktivität von Pulverprodukten nicht beeinträchtigt. Nach dem Sammeln lagern Sie das Produkt bitte gemäß den in der Datenblatt beschriebenen Anforderungen. Die meisten Selleck-Produkte sind unter den empfohlenen Bedingungen stabil.
NICHT FÜR DIE ANWENDUNG AM MENSCHEN, FÜR VETERINÄRMEDIZINISCHE DIAGNOSTIK ODER THERAPEUTISCHE ZWECKE.
