Technische Daten
| Formel | C32H29N5O2 |
||||||
| Molekulargewicht | 515.61 | CAS-Nr. | 170364-57-5 | ||||
| Löslichkeit (25°C)* | In vitro | DMSO | 30 mg/mL (58.18 mM) | ||||
| Water | Insoluble | ||||||
| Ethanol | Insoluble | ||||||
| In vivo (Lösungsmittel einzeln und der Reihe nach zum Produkt hinzufügen.) |
|
||||||
|
* <1 mg/ml bedeutet schwer löslich oder unlöslich. * Bitte beachten Sie, dass Selleck die Löslichkeit aller Verbindungen intern testet und die tatsächliche Löslichkeit geringfügig von veröffentlichten Werten abweichen kann. Dies ist normal und ist auf geringfügige Batch-zu-Batch-Variationen zurückzuführen. * Versand bei Raumtemperatur (Stabilitätstests zeigen, dass dieses Produkt ohne Kühlmaßnahmen versendet werden kann.) |
|||||||
Vorbereitung von Stammlösungen
Biologische Aktivität
| Beschreibung | Enzastaurin ist ein potenter PKCβ-selektiver Inhibitor mit einer IC50 von 6 nM in zellfreien Assays, mit einer 6- bis 20-fachen Selektivität gegenüber PKCα, PKCγ und PKCε. Phase 3. | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| Ziele |
|
||||||||
| In vitro | Die Anwendung von Enzastaurin führt zu einer deutlichen dosisabhängigen Hemmung des Wachstums in allen untersuchten MM-Zelllinien, einschließlich MM.1S, MM.1R, RPMI 8226 (RPMI), RPMI-Dox40 (Dox40), NCI-H929, KMS-11, OPM-2 und U266, mit IC50-Werten von 0,6-1,6 μM. Diese Verbindung wirkt direkt auf menschliche Tumorzellen, induziert Apoptose und unterdrückt die Proliferation in kultivierten Tumorzellen. Sie unterdrückt auch die Phosphorylierung von GSK3βser9, dem ribosomalen Protein S6S240/244 und AKTThr308, während sie keinen direkten Effekt auf die VEGFR-Phosphorylierung hat. Diese Chemikalie erhöht die Apoptose in malignen Lymphozyten von CTCL. In Kombination mit GSK3-Inhibitoren zeigte sie eine Verbesserung der Zytotoxizitätsniveaus. Die Behandlung mit einer Kombination dieser Verbindung und des GSK3-Inhibitors AR-A014418 führte zu erhöhten Spiegeln an β-Catenin-Gesamtprotein und β-Catenin-vermittelter Transkription. Die Blockierung der β-Catenin-vermittelten Transkription oder der kleine Haarnadel-RNA (shRNA)-Knockdown von β-Catenin induzierte die gleichen zytotoxischen Effekte wie die Kombination mit AR-A014418. Zusätzlich führte die Behandlung mit dieser Verbindung und AR-A014418 zu einer Abnahme der mRNA-Spiegel und der Oberflächenexpression von CD44. |
||||||||
| In vivo | Die Behandlung von Xenotransplantaten mit Enzastaurin und Strahlung führte zu einer stärkeren Verringerung der Mikrovaskulaturdichte als jede Einzelbehandlung. Die Abnahme der Mikrovaskulaturdichte korrelierte mit einem verzögerten Tumorwachstum. |
Protokoll (aus Referenz)
| Kinase-Assay: |
|
|---|---|
| Zell-Assay: |
|
| Tierstudie: |
|
Referenzen
|
Kundenproduktvalidierung
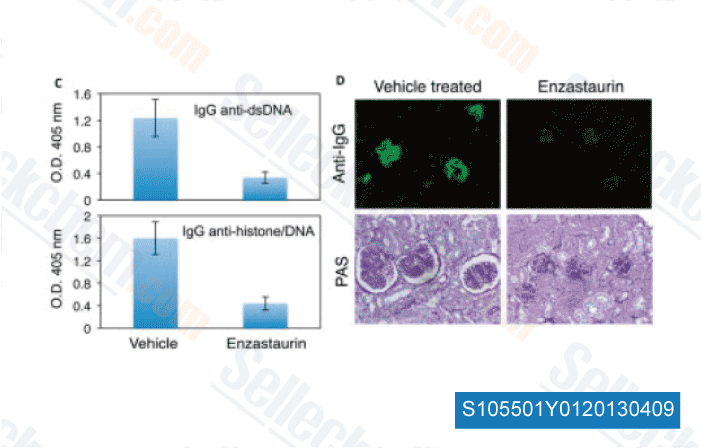
-
Daten von [ Arthritis Rheum , 2013 , 65, 1022-31 ]
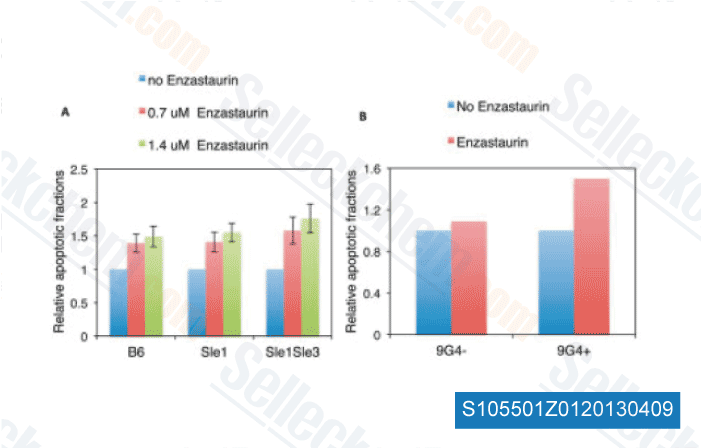
-
Daten von [ Arthritis Rheum , 2013 , 65, 1022-31 ]
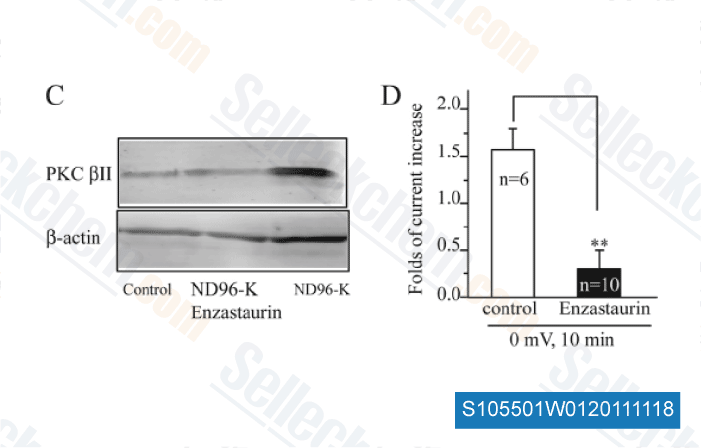
-
Daten von [ J Biol Chem , 2011 , 286, 39760-7 ]
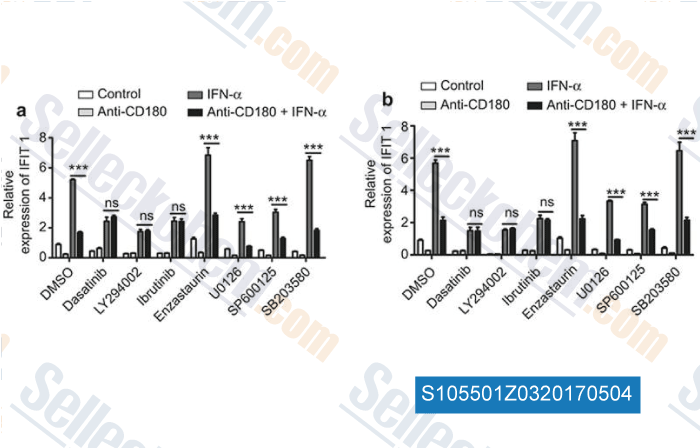
-
Daten von [ , , Cell Mol Immunol, 2017, 14(2):192-202 ]
Sellecks Enzastaurin Wurde zitiert von 67 Publikationen
| IDH status dictates oHSV mediated metabolic reprogramming affecting anti-tumor immunity [ Nat Commun, 2025, 16(1):3874] | PubMed: 40274791 |
| Glioblastoma Tumor Microtubes and Brain Fatty Acid-binding Protein: Path to Directional Infiltration [ Neuro Oncol, 2025, noaf200] | PubMed: 40891350 |
| A patient-derived T cell lymphoma biorepository uncovers pathogenetic mechanisms and host-related therapeutic vulnerabilities [ Cell Rep Med, 2025, S2666-3791(25)00102-8] | PubMed: 40147445 |
| A genome-wide association study identified PRKCB as a causal gene and therapeutic target for Mycobacterium avium complex disease [ Cell Rep Med, 2025, S2666-3791(24)00694-3] | PubMed: 39848245 |
| Single-cell analysis reveals transcriptomic features and therapeutic targets in primary pulmonary lymphoepithelioma-like carcinoma [ Commun Biol, 2025, 8(1):394] | PubMed: 40057671 |
| Patient-derived rhabdomyosarcoma cells recapitulate the genetic and transcriptomic landscapes of primary tumors [ iScience, 2024, 27(10):110862] | PubMed: 39319271 |
| Epoxytiglianes induce keratinocyte wound healing responses via classical protein kinase C activation to promote skin re-epithelialization [ Biochem Pharmacol, 2024, 230(Pt 2):116607] | PubMed: 39489221 |
| PKCβII phosphorylates ACSL4 to amplify lipid peroxidation to induce ferroptosis [ Nat Cell Biol, 2022, 24(1):88-98] | PubMed: 35027735 |
| Targeting a splicing-mediated drug resistance mechanism in prostate cancer by inhibiting transcriptional regulation by PKCβ1 [ Oncogene, 2022, 10.1038/s41388-022-02179-z] | PubMed: 35087237 |
| Inhibition of IκB Kinase Is a Potential Therapeutic Strategy to Circumvent Resistance to Epidermal Growth Factor Receptor Inhibition in Triple-Negative Breast Cancer Cells [ Cancers (Basel), 2022, 14(21)5215] | PubMed: 36358633 |
RÜCKGABERICHTLINIE
Die bedingungslose Rückgaberichtlinie von Selleck Chemical gewährleistet unseren Kunden ein reibungsloses Online-Einkaufserlebnis. Wenn Sie in irgendeiner Weise mit Ihrem Kauf unzufrieden sind, können Sie jeden Artikel innerhalb von 7 Tagen nach Erhalt zurückgeben. Im Falle von Produktqualitätsproblemen, sei es protokollbezogene oder produktbezogene Probleme, können Sie jeden Artikel innerhalb von 365 Tagen ab dem ursprünglichen Kaufdatum zurückgeben. Bitte befolgen Sie die nachstehenden Anweisungen, wenn Sie Produkte zurücksenden.
VERSAND UND LAGERUNG
Selleck-Produkte werden bei Raumtemperatur transportiert. Wenn Sie das Produkt bei Raumtemperatur erhalten, seien Sie versichert, dass die Qualitätskontrollabteilung von Selleck Experimente durchgeführt hat, um zu überprüfen, dass die normale Temperaturplatzierung von einem Monat die biologische Aktivität von Pulverprodukten nicht beeinträchtigt. Nach dem Sammeln lagern Sie das Produkt bitte gemäß den in der Datenblatt beschriebenen Anforderungen. Die meisten Selleck-Produkte sind unter den empfohlenen Bedingungen stabil.
NICHT FÜR DIE ANWENDUNG AM MENSCHEN, FÜR VETERINÄRMEDIZINISCHE DIAGNOSTIK ODER THERAPEUTISCHE ZWECKE.
