Technische Daten
| Formel | C20H20N4O |
||||||
| Molekulargewicht | 332.4 | CAS-Nr. | 1000669-72-6 | ||||
| Löslichkeit (25°C)* | In vitro | DMSO | 67 mg/mL (201.56 mM) | ||||
| Ethanol | 67 mg/mL (201.56 mM) | ||||||
| Water | Insoluble | ||||||
| In vivo (Lösungsmittel einzeln und der Reihe nach zum Produkt hinzufügen.) |
|
||||||
|
* <1 mg/ml bedeutet schwer löslich oder unlöslich. * Bitte beachten Sie, dass Selleck die Löslichkeit aller Verbindungen intern testet und die tatsächliche Löslichkeit geringfügig von veröffentlichten Werten abweichen kann. Dies ist normal und ist auf geringfügige Batch-zu-Batch-Variationen zurückzuführen. * Versand bei Raumtemperatur (Stabilitätstests zeigen, dass dieses Produkt ohne Kühlmaßnahmen versendet werden kann.) |
|||||||
Vorbereitung von Stammlösungen
Biologische Aktivität
| Beschreibung | KW-2449 ist ein Multi-Target-Inhibitor, hauptsächlich für Flt3 mit einem IC50 von 6,6 nM, mäßig potent gegenüber FGFR1, Bcr-Abl und Aurora A; geringe Wirkung auf PDGFRβ, IGF-1R, EGFR. Phase 1. | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Ziele |
|
|||||||||||
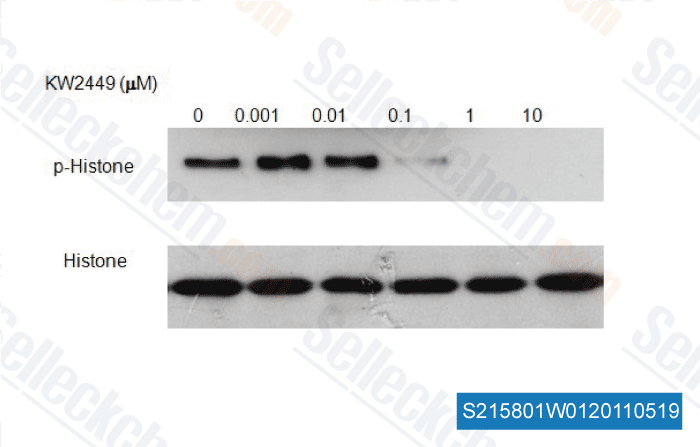
| In vitro | KW-2449, ein Multikinase-Inhibitor von FLT3, ABL, ABL-T315I und Aurora Kinase, wird zur Behandlung von Leukämiepatienten untersucht. Diese Verbindung zeigt potente wachstumshemmende Effekte auf Leukämiezellen mit FLT3-Mutationen durch Hemmung der FLT3-Kinase, was zu einer Herunterregulierung von phosphoryliertem-FLT3/STAT5, G1-Arrest und Apoptose führt. Die orale Verabreichung dieser Chemikalie zeigt eine dosisabhängige und signifikante Tumorwachstumshemmung in einem FLT3-mutierten Xenotransplantationsmodell mit minimaler Knochenmarksuppression. Bei FLT3-Wildtyp-Humanleukämie induziert es die Reduktion von phosphoryliertem Histon H3, G2/M-Arrest und Apoptose. Bei Imatinib-resistenter Leukämie trägt dieser Wirkstoff zur Aufhebung der Resistenz durch die gleichzeitige Herunterregulierung von BCR/ABL und Aurora Kinases bei. Die hemmende Aktivität dieser Verbindung wird durch die Anwesenheit von menschlichem Plasmaprotein, wie α1-saures Glykoprotein, nicht beeinflusst. Es besitzt eine potente wachstumshemmende Aktivität gegen verschiedene Arten von Leukämie durch mehrere Wirkmechanismen. Dieser Inhibitor hat eine signifikante Aktivität und rechtfertigt klinische Studien bei Leukämiepatienten mit FLT3-Mutationen sowie Imatinib-resistenten Mutationen. Die Phosphorylierungsgrade von FLT3 und STAT5 werden durch diese Chemikalie dosisabhängig gesenkt. Darüber hinaus hemmt es potent ABL-T315I, das mit IM-Resistenz assoziiert ist, mit einem IC50 von 4 nM. Andererseits hat diese Verbindung selbst bei einer Konzentration von 1 μM wenig Einfluss auf PDGFRβ, IGF-1R, EGFR und verschiedene Serin/Threonin-Kinasen. Es besitzt potente wachstumshemmende Aktivitäten nicht nur gegen FLT3/ITD-exprimierende Leukämiezellen, sondern auch gegen FLT3/KDM-aktivierte und Wildtyp-FLT3-überexprimierende Leukämiezellen. In Übereinstimmung mit dem wachstumshemmenden Effekt unterdrückt dieser Wirkstoff die Phosphorylierungen von FLT3 (P-FLT3) und seinem nachgeschalteten Molekül Phospho-STAT5 (P-STAT5) in MOLM-13-Zellen dosisabhängig. Darüber hinaus erhöht es den Prozentsatz der Zellen in der G1-Phase des Zellzyklus und reduziert reziprok den Prozentsatz der Zellen in der S-Phase, was zu einer Zunahme der apoptotischen Zellpopulation führt. Diese Verbindung kann konstitutiv aktive WT-FLT3-Kinase dephosphorylieren, aber die Proliferation von Leukämiezellen nicht hemmen, wenn sie nicht hauptsächlich von der FLT3-Kinase abhängig sind. Es wird schnell resorbiert und zu einem Hauptmetaboliten M1 umgewandelt. Präklinische Studien zeigen, dass diese Chemikalie durch Monoaminoxidase-B (MAO-B) und Aldehydoxidase in ihren Hauptmetaboliten M1 umgewandelt wird. Dieser Wirkstoff vermittelt Zytotoxizität durch Hemmung von FLT3/ITD. Er ist ein direkter Inhibitor von FLT3 und induziert die Hemmung seines nachgeschalteten Ziels STAT5. Diese Verbindung interagiert synergistisch mit HDACI, um Apoptose in Ph+ CML-Zellen zeit- und konzentrationsabhängig zu induzieren. Sie verstärkt synergistisch die Letalität von Vorinostat/SNDX275 in CML-Zellen. Diese Inhibitor-Regime sind aktiv gegen zusätzliche IM-resistente Bcr/Abl+-Leukämiezellen. Es reduziert moderat die Phosphorylierung von Histon H3, ein Indikator für die Aurora B-Aktivität, in Nocodozol-behandelten K562-Zellen. | |||||||||||
| In vivo | Im MOLM-13-Tumorxenograftmodell zeigt die orale Verabreichung von KW-2449 über 14 Tage eine potente und signifikante Antitumorwirkung in dosisabhängiger Weise. | |||||||||||
| Merkmale | Wurde als FLT3-Inhibitor in klinischen Studien untersucht, weitere befinden sich in der frühen Entwicklung. |
Protokoll (aus Referenz)
| Kinase-Assay:[2] |
|
|---|---|
| Zell-Assay: [1] |
|
| Tierstudie:[3] |
|
Referenzen
|
Kundenproduktvalidierung
-
, , Dr. Zhang of Tianjin Medical University
Sellecks KW-2449 Wurde zitiert von 12 Publikationen
| Integrative analysis of drug response and clinical outcome in acute myeloid leukemia [ Cancer Cell, 2022, S1535-6108(22)00312-9] | PubMed: 35868306 |
| A community challenge for a pancancer drug mechanism of action inference from perturbational profile data [ Cell Rep Med, 2022, 3(1):100492] | PubMed: 35106508 |
| Phosphorylation of SHP2 at Tyr62 Enables Acquired Resistance to SHP2 Allosteric Inhibitors in FLT3-ITD-Driven AML [ Cancer Res, 2022, 82(11):2141-2155] | PubMed: 35311954 |
| KW-2449 and VPA exert therapeutic effects on human neurons and cerebral organoids derived from MECP2-null hESCs [ Stem Cell Res Ther, 2022, 13(1):534] | PubMed: 36575558 |
| Evaluation of CML TKI Induced Cardiovascular Toxicity and Development of Potential Rescue Strategies in a Zebrafish Model [ Front Pharmacol, 2021, 12:740529] | PubMed: 34733159 |
| Mechanisms of Oncogenesis in the Primary Liver Cell Cancer [ DTIC, 2021, 53] | PubMed: None |
| The Global Phosphorylation Landscape of SARS-CoV-2 Infection [ Cell, 2020, 182(3):685-712.e19] | PubMed: 32645325 |
| Synergistic Anti Leukemia Effect of a Novel Hsp90 and a Pan Cyclin Dependent Kinase Inhibitors. [ Molecules, 2020, 8;25(9) pii: E2220] | PubMed: 32397330 |
| Small-Molecule and CRISPR Screening Converge to Reveal Receptor Tyrosine Kinase Dependencies in Pediatric Rhabdoid Tumors. [ Cell Rep, 2019, 28(9):2331-2344] | PubMed: 31461650 |
| Drug Target Commons: A Community Effort to Build a Consensus Knowledge Base for Drug-Target Interactions [Tang J Cell Chem Biol, 2018, 25(2):224-229] | PubMed: 29276046 |
RÜCKGABERICHTLINIE
Die bedingungslose Rückgaberichtlinie von Selleck Chemical gewährleistet unseren Kunden ein reibungsloses Online-Einkaufserlebnis. Wenn Sie in irgendeiner Weise mit Ihrem Kauf unzufrieden sind, können Sie jeden Artikel innerhalb von 7 Tagen nach Erhalt zurückgeben. Im Falle von Produktqualitätsproblemen, sei es protokollbezogene oder produktbezogene Probleme, können Sie jeden Artikel innerhalb von 365 Tagen ab dem ursprünglichen Kaufdatum zurückgeben. Bitte befolgen Sie die nachstehenden Anweisungen, wenn Sie Produkte zurücksenden.
VERSAND UND LAGERUNG
Selleck-Produkte werden bei Raumtemperatur transportiert. Wenn Sie das Produkt bei Raumtemperatur erhalten, seien Sie versichert, dass die Qualitätskontrollabteilung von Selleck Experimente durchgeführt hat, um zu überprüfen, dass die normale Temperaturplatzierung von einem Monat die biologische Aktivität von Pulverprodukten nicht beeinträchtigt. Nach dem Sammeln lagern Sie das Produkt bitte gemäß den in der Datenblatt beschriebenen Anforderungen. Die meisten Selleck-Produkte sind unter den empfohlenen Bedingungen stabil.
NICHT FÜR DIE ANWENDUNG AM MENSCHEN, FÜR VETERINÄRMEDIZINISCHE DIAGNOSTIK ODER THERAPEUTISCHE ZWECKE.
