Technische Daten
| Formel | C37H42F2N8O4 |
||||||
| Molekulargewicht | 700.78 | CAS-Nr. | 171228-49-2 | ||||
| Löslichkeit (25°C)* | In vitro | DMSO | 100 mg/mL (142.69 mM) | ||||
| Water | Insoluble | ||||||
| Ethanol | Insoluble | ||||||
| In vivo (Lösungsmittel einzeln und der Reihe nach zum Produkt hinzufügen.) |
|
||||||
|
* <1 mg/ml bedeutet schwer löslich oder unlöslich. * Bitte beachten Sie, dass Selleck die Löslichkeit aller Verbindungen intern testet und die tatsächliche Löslichkeit geringfügig von veröffentlichten Werten abweichen kann. Dies ist normal und ist auf geringfügige Batch-zu-Batch-Variationen zurückzuführen. * Versand bei Raumtemperatur (Stabilitätstests zeigen, dass dieses Produkt ohne Kühlmaßnahmen versendet werden kann.) |
|||||||
Vorbereitung von Stammlösungen
Biologische Aktivität
| Beschreibung | Posaconazole ist ein Inhibitor primär von CYP3A4, hemmt jedoch nicht die Aktivität anderer CYP-Enzyme; auch ein Inhibitor der Sterol-C14ɑ-Demethylase mit einer IC50 von 0,25 μM. Diese Verbindung hat eine mittlere terminale Eliminationshalbwertszeit von 15-35 Stunden. | ||
|---|---|---|---|
| Ziele |
|
||
| In vitro | Posaconazole hat eine starke trypanozide Aktivität. Amiodaron wirkt synergistisch mit dieser Verbindung. Es beeinflusst und stört auch die Ca2+-Homöostase in T. cruzi. Diese Chemikalie blockiert die Biosynthese von Ergosterol, das für das Überleben des Parasiten unerlässlich ist. Es hat eine klare, dosisabhängige Wirkung auf die Proliferation der Epimastigoten (extrazelluläre) Stadien, mit einer minimalen Hemmkonzentration von 20 nM und einer IC50 von 14 nM. Gegen die klinisch relevante intrazelluläre Amastigotenform des Parasiten ist diese Verbindung noch wirksamer. Sie hat minimale Hemmkonzentrationen und IC50-Werte von 3 nM und 0,25 nM. Es ist wirksam gegen Isolate von Candida- und Aspergillus spp., die Resistenzen gegen Fluconazol, Voriconazol und Amphotericin B aufweisen, und ist viel aktiver als die anderen Triazole gegen Zygomyzeten. |
||
| In vivo | Die Behandlung infizierter Tiere mit Amiodaron allein reduziert die Parasitämie, erhöht das Überleben 60 Tage p.i. (0 % bei unbehandelten Kontrollen vs. 40 % bei mit Amiodaron behandelten Tieren) und verzögert, wenn es in Kombination mit Posaconazole verabreicht wird, die Entwicklung der Parasitämie. Die gleichzeitige Verabreichung dieser Verbindung und Boost Plus erhöht die Medikamentenexposition im Vergleich zur Verabreichung dieser Verbindung allein im nüchternen Zustand. Nahrung, insbesondere Mahlzeiten mit hohem Fettgehalt, erhöht die Bioverfügbarkeit dieser Verbindung signifikant. Die systemische Exposition gegenüber dieser Verbindung steigt um das 4- bzw. 2,6-Fache, wenn sie mit einer fettreichen bzw. fettfreien Mahlzeit eingenommen wird. Diese Verbindung und Amiodaron könnten eine wirksame Anti-T. cruzi-Therapie mit geringen Nebenwirkungen darstellen. Bei zweimal täglichen Dosen von Gleichzeitig verabreichtes Amiodaron und Boost Plus erhöhen die Exposition gegenüber dem Wirkstoff im Vergleich zur alleinigen Verabreichung im nüchternen Zustand. Nahrung, insbesondere fettreiche Mahlzeiten, erhöhen die Bioverfügbarkeit dieser Verbindung signifikant. Die systemische Exposition gegenüber dieser Verbindung steigt um das 4- bzw. 2,6-Fache, wenn sie mit einer fettreichen bzw. fettfreien Mahlzeit eingenommen wird. Diese Verbindung und Amiodaron könnten eine wirksame Anti-T. cruzi-Therapie mit geringen Nebenwirkungen darstellen. Bei zweimal täglichen Dosen von ≥15 mg/kg Körpergewicht verlängert diese Verbindung das Überleben der Mäuse und reduziert die Gewebebelastung. |
||
| Merkmale | Derzeit der am weitesten fortgeschrittene Kandidat zur Behandlung der Chagas-Krankheit. |
Protokoll (aus Referenz)
| Zell-Assay: |
|
|---|---|
| Tierstudie: |
|
Referenzen
|
Kundenproduktvalidierung
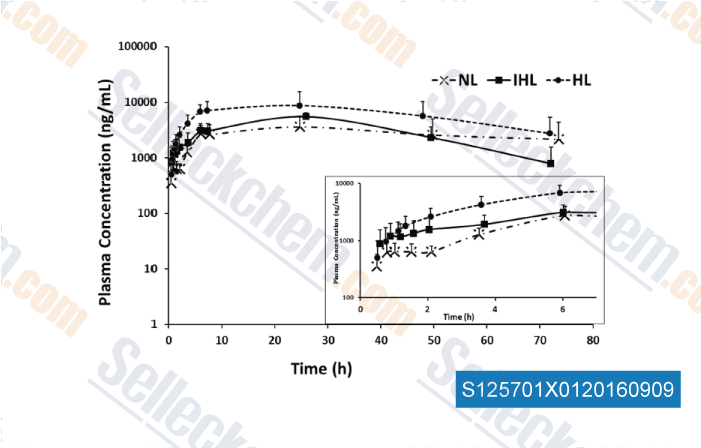
-
Daten von [ , , Eur J Pharm Sci, 2016, 91:190-195. ]
Sellecks Posaconazole Wurde zitiert von 28 Publikationen
| Pyrvinium Pamoate Synergizes with Azoles in vitro and in vivo to Exert Antifungal Efficacy Against Candida auris and Other Candida Species [ Infect Drug Resist, 2025, 18:783-789] | PubMed: 39958982 |
| Interactions between antifungals and everolimus against Cryptococcus neoformans [ Front Cell Infect Microbiol, 2023, 13:1131641] | PubMed: 37026056 |
| The Synergistic Effect of Tacrolimus (FK506) or Everolimus and Azoles Against Scedosporium and Lomentospora Species In Vivo and In Vitro [ Front Cell Infect Microbiol, 2022, 12:864912] | PubMed: 35493742 |
| Synergistic effect of pyrvinium pamoate and posaconazole against Cryptococcus neoformans in vitro and in vivo [ Front Cell Infect Microbiol, 2022, 12:1074903] | PubMed: 36569209 |
| Terconazole, an Azole Antifungal Drug, Increases Cytotoxicity in Antimitotic Drug-Treated Resistant Cancer Cells with Substrate-Specific P-gp Inhibitory Activity [ Int J Mol Sci, 2022, 23(22)13809] | PubMed: 36430288 |
| A Preliminary in vitro and in vivo Evaluation of the Effect and Action Mechanism of 17-AAG Combined With Azoles Against Azole-Resistant Candida spp [ Front Microbiol, 2022, 13:825745] | PubMed: 35875545 |
| The synergistic effect of minocycline and azole antifungal drugs against Scedosporium and Lomentospora species [ BMC Microbiol, 2022, 22(1):21] | PubMed: 35016611 |
| The Role of Isavuconazonium Sulphate for the Treatment of Blastomycosis: A Case Series and Antifungal Susceptibility [ Open Forum Infect Dis, 2022, 9(7):ofac220] | PubMed: 35821730 |
| In Vitro and In Vivo Interactions of TOR Inhibitor AZD8055 and Azoles against Pathogenic Fungi [ Microbiol Spectr, 2022, 10(1):e0200721] | PubMed: 35019705 |
| Antifungal Activity of Minocycline and Azoles Against Fluconazole-Resistant Candida Species [ Front Microbiol, 2021, 12:649026] | PubMed: 34054751 |
RÜCKGABERICHTLINIE
Die bedingungslose Rückgaberichtlinie von Selleck Chemical gewährleistet unseren Kunden ein reibungsloses Online-Einkaufserlebnis. Wenn Sie in irgendeiner Weise mit Ihrem Kauf unzufrieden sind, können Sie jeden Artikel innerhalb von 7 Tagen nach Erhalt zurückgeben. Im Falle von Produktqualitätsproblemen, sei es protokollbezogene oder produktbezogene Probleme, können Sie jeden Artikel innerhalb von 365 Tagen ab dem ursprünglichen Kaufdatum zurückgeben. Bitte befolgen Sie die nachstehenden Anweisungen, wenn Sie Produkte zurücksenden.
VERSAND UND LAGERUNG
Selleck-Produkte werden bei Raumtemperatur transportiert. Wenn Sie das Produkt bei Raumtemperatur erhalten, seien Sie versichert, dass die Qualitätskontrollabteilung von Selleck Experimente durchgeführt hat, um zu überprüfen, dass die normale Temperaturplatzierung von einem Monat die biologische Aktivität von Pulverprodukten nicht beeinträchtigt. Nach dem Sammeln lagern Sie das Produkt bitte gemäß den in der Datenblatt beschriebenen Anforderungen. Die meisten Selleck-Produkte sind unter den empfohlenen Bedingungen stabil.
NICHT FÜR DIE ANWENDUNG AM MENSCHEN, FÜR VETERINÄRMEDIZINISCHE DIAGNOSTIK ODER THERAPEUTISCHE ZWECKE.
