Technische Daten
| Formel | C21H16ClF3N4O3.C7H8O3S |
||||||||||||||
| Molekulargewicht | 637.03 | CAS-Nr. | 475207-59-1 | ||||||||||||
| Löslichkeit (25°C)* | In vitro | DMSO | 127 mg/mL (199.36 mM) | ||||||||||||
| Water | 0.01 mg/mL (0.01 mM) | ||||||||||||||
| Ethanol | Insoluble | ||||||||||||||
| In vivo (Lösungsmittel einzeln und der Reihe nach zum Produkt hinzufügen.) |
|
||||||||||||||
|
* <1 mg/ml bedeutet schwer löslich oder unlöslich. * Bitte beachten Sie, dass Selleck die Löslichkeit aller Verbindungen intern testet und die tatsächliche Löslichkeit geringfügig von veröffentlichten Werten abweichen kann. Dies ist normal und ist auf geringfügige Batch-zu-Batch-Variationen zurückzuführen. * Versand bei Raumtemperatur (Stabilitätstests zeigen, dass dieses Produkt ohne Kühlmaßnahmen versendet werden kann.) |
|||||||||||||||
Vorbereitung von Stammlösungen
Biologische Aktivität
| Beschreibung | Sorafenib Tosylate ist ein Multikinase-Inhibitor von Raf-1 und B-Raf mit einem IC50 von 6 nM bzw. 22 nM in zellfreien Assays. Sorafenib Tosylate hemmt VEGFR-2, VEGFR-3, PDGFR-β, Flt-3 und c-KIT mit IC50-Werten von 90 nM, 20 nM, 57 nM, 59 nM bzw. 68 nM. Sorafenib Tosylate induziert autophagy und apoptosis und aktiviert ferroptosis mit Antitumoraktivität. | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Ziele |
|
|||||||||||
| In vitro | Sorafenib tosylate hemmt sowohl die Wildtyp- als auch die V599E-Mutante-B-Raf-Aktivität mit einer IC50 von 22 nM bzw. 38 nM. Diese Verbindung hemmt auch mVEGFR2 (Flk-1), mVEGFR3, mPDGFRβ, FLT3 und c-Kit mit einer IC50 von 15 nM, 20 nM, 57 nM, 58 nM bzw. 68 nM. Sie hemmt FGFR-1 schwach mit einem IC50-Wert von 580 nM. Diese Chemikalie ist nicht aktiv gegen ERK-1, MEK-1, EGRF, HER-2, IGFR-1, c-Met, PKB, PKA, cdk1/CyclinB, PKCα, PKCγ und pim-1. Es hemmt deutlich die VEGFR2-Phosphorylierung in NIH 3T3-Zellen mit einer IC50 von 30 nM und die FLT-3-Phosphorylierung in HEK-293-Zellen mit einer IC50 von 20 nM. Es blockiert wirksam die MEK 1/2- und ERK 1/2-Phosphorylierung in den meisten Zelllinien, jedoch nicht in A549- oder H460-Zellen, während es keine Wirkung auf die Hemmung des PKB-Signalwegs hat. Es hemmt die Proliferation von HAoSMC- und MDA-MB-231-Zellen mit einer IC50 von 0,28 μM bzw. 2,6 μM. Zusätzlich zur Hemmung des Raf/MEK/ERK-Signalwegs hemmt es signifikant die Phosphorylierung von eIF4E und reguliert die Mcl-1-Spiegel in Hepatozellulären Karzinomzellen (HCC) auf MEK/ERK-unabhängige Weise herunter. Es hemmt die Proliferation von PLC/PRF/5- und HepG2-Zellen mit einer IC50 von 6,3 μM bzw. 4,5 μM und führt zu einer signifikanten Induktion der Apoptosis. |
|||||||||||
| In vivo | Die orale Verabreichung von Sorafenib tosylate (~60 mg/kg) zeigt eine breite, dosisabhängige Antitumoraktivität gegen eine Vielzahl von menschlichen Tumoren in Xenotransplantatmodellen, darunter MDA-MB-231, Colo-205, HT-29, DLD-1, NCI-H460 und A549, ohne Anzeichen von Toxizität. In Verbindung mit der Antitumorwirksamkeit hemmt diese Verbindung wirksam die MEK 1/2-Phosphorylierung und die pPERK 1/2-Spiegel in HT-29- und MDA-MB-231-Xenotransplantaten, jedoch nicht in Colo-205-Xenotransplantaten, und unterdrückt signifikant die Tumormikrogefäßfläche (MVA) und die Mikrogefäßdichte (MVD) in MDA MB-231-, HT-29 und Colo-205-Tumor-Xenotransplantaten. Diese Kombinationsbehandlung bewirkt eine dosisabhängige Wachstumshemmung von PLC/PRF/5-Tumor-Xenotransplantaten in SCID-Mäusen mit TGIs von 49 % bzw. 78 % bei 10 mg/kg und 30 mg/kg, was mit der Hemmung der ERK- und eIF4E-Phosphorylierung, der Verringerung der Mikrogefäßfläche und der Induktion der Apoptosis von Tumorzellen übereinstimmt. |
Protokoll (aus Referenz)
| Kinase-Assay: |
|
|---|---|
| Zell-Assay: |
|
| Tierstudie: |
|
Referenzen
|
Kundenproduktvalidierung
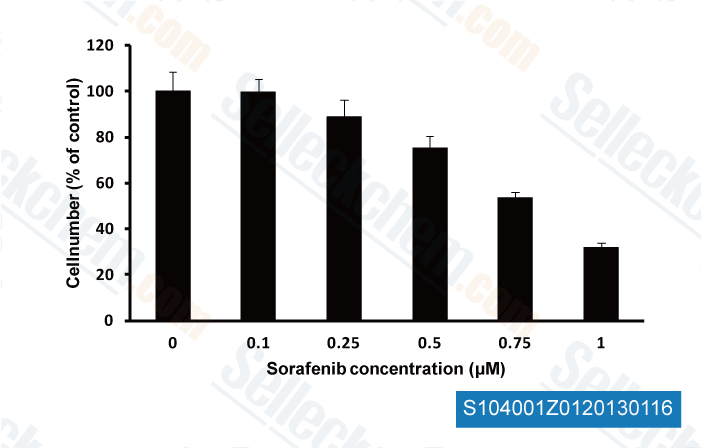
-
, 2013 , Christina W Yde/CDM Danish Cancer Society Research Center Denmark
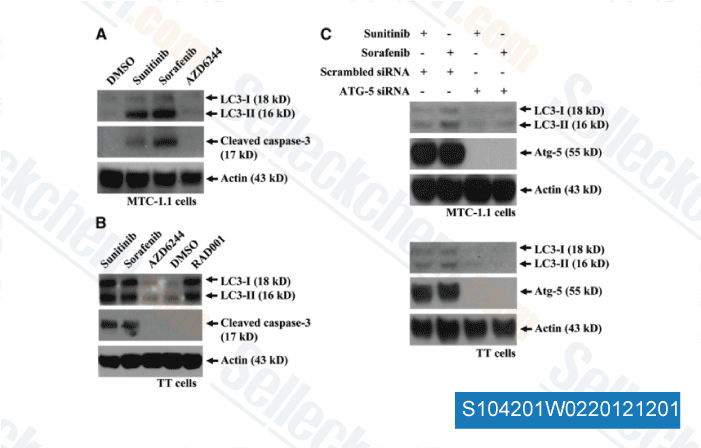
-
Daten von [ Surgery , 2012 , 152(6), 1142-9 ]
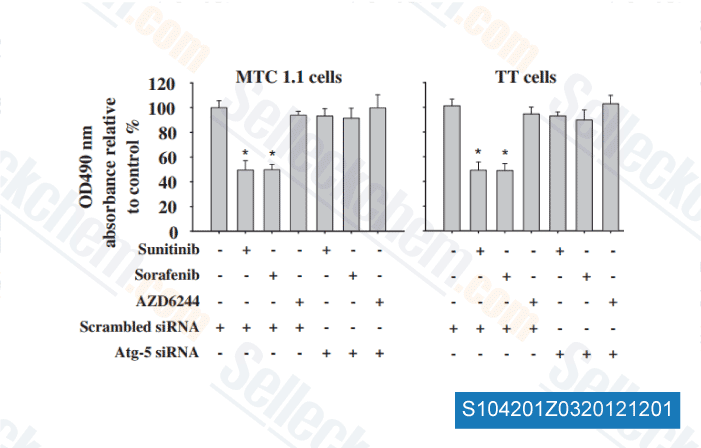
-
Daten von [ Surgery , 2012 , 152(6), 1142-9 ]
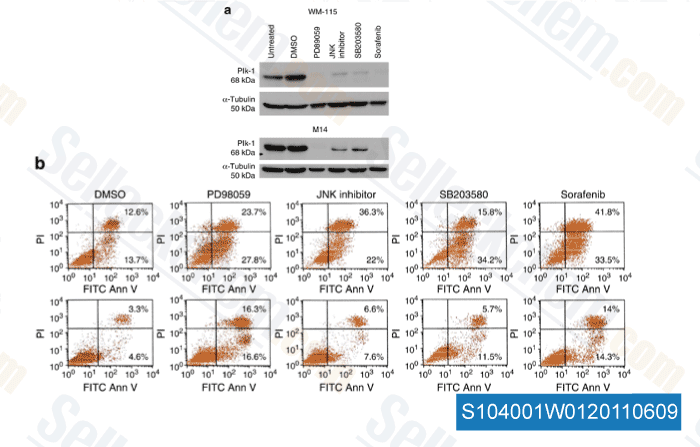
-
Daten von [ J Invest Dermatol , 2011 , 131, 1886–1895 ]
Sellecks Sorafenib Tosylate (BAY 43-9006) Wurde zitiert von 274 Publikationen
| Inhibiting SSBP1 enhances ferroptosis and improves the effectiveness of sorafenib treatment for liver cancer [ Int J Oncol, 2025, 67(3)72] | PubMed: 40747667 |
| Tumour-selective activity of RAS-GTP inhibition in pancreatic cancer [ Nature, 2024, 629(8013):927-936] | PubMed: 38588697 |
| Targeting NG2 relieves the resistance of BRAF-mutant thyroid cancer cells to BRAF inhibitors [ Cell Mol Life Sci, 2024, 81(1):238] | PubMed: 38795180 |
| Mitochondrial GCN5L1 acts as a novel regulator for iron homeostasis to promote sorafenib sensitivity in hepatocellular carcinoma [ J Transl Med, 2024, 22(1):593] | PubMed: 38918793 |
| IL-22 signaling promotes sorafenib resistance in hepatocellular carcinoma via STAT3/CD155 signaling axis [ Front Immunol, 2024, 15:1373321] | PubMed: 38596684 |
| Patient-derived rhabdomyosarcoma cells recapitulate the genetic and transcriptomic landscapes of primary tumors [ iScience, 2024, 27(10):110862] | PubMed: 39319271 |
| EZH2 suppresses ferroptosis in hepatocellular carcinoma and reduces sorafenib sensitivity through epigenetic regulation of TFR2 [ Cancer Sci, 2024, 115(7):2220-2234] | PubMed: 38623968 |
| Upregulation of LHPP by saRNA inhibited hepatocellular cancer cell proliferation and xenograft tumor growth [ PLoS One, 2024, 19(5):e0299522] | PubMed: 38696452 |
| Gravitational and mechanical forces drive mitochondrial translation [ bioRxiv, 2024, 10.1101/2023.01.18.524628] | PubMed: none |
| Arginine reprograms metabolism in liver cancer via RBM39 [ Cell, 2023, 186(23):5068-5083.e23] | PubMed: 37804830 |
RÜCKGABERICHTLINIE
Die bedingungslose Rückgaberichtlinie von Selleck Chemical gewährleistet unseren Kunden ein reibungsloses Online-Einkaufserlebnis. Wenn Sie in irgendeiner Weise mit Ihrem Kauf unzufrieden sind, können Sie jeden Artikel innerhalb von 7 Tagen nach Erhalt zurückgeben. Im Falle von Produktqualitätsproblemen, sei es protokollbezogene oder produktbezogene Probleme, können Sie jeden Artikel innerhalb von 365 Tagen ab dem ursprünglichen Kaufdatum zurückgeben. Bitte befolgen Sie die nachstehenden Anweisungen, wenn Sie Produkte zurücksenden.
VERSAND UND LAGERUNG
Selleck-Produkte werden bei Raumtemperatur transportiert. Wenn Sie das Produkt bei Raumtemperatur erhalten, seien Sie versichert, dass die Qualitätskontrollabteilung von Selleck Experimente durchgeführt hat, um zu überprüfen, dass die normale Temperaturplatzierung von einem Monat die biologische Aktivität von Pulverprodukten nicht beeinträchtigt. Nach dem Sammeln lagern Sie das Produkt bitte gemäß den in der Datenblatt beschriebenen Anforderungen. Die meisten Selleck-Produkte sind unter den empfohlenen Bedingungen stabil.
NICHT FÜR DIE ANWENDUNG AM MENSCHEN, FÜR VETERINÄRMEDIZINISCHE DIAGNOSTIK ODER THERAPEUTISCHE ZWECKE.
