Technische Daten
| Formel | C18H18N2O3 |
||||||||||
| Molekulargewicht | 310.35 | CAS-Nr. | 252916-29-3 | ||||||||
| Löslichkeit (25°C)* | In vitro | DMSO | 62 mg/mL (199.77 mM) | ||||||||
| Water | Insoluble | ||||||||||
| Ethanol | Insoluble | ||||||||||
| In vivo (Lösungsmittel einzeln und der Reihe nach zum Produkt hinzufügen.) |
|
||||||||||
|
* <1 mg/ml bedeutet schwer löslich oder unlöslich. * Bitte beachten Sie, dass Selleck die Löslichkeit aller Verbindungen intern testet und die tatsächliche Löslichkeit geringfügig von veröffentlichten Werten abweichen kann. Dies ist normal und ist auf geringfügige Batch-zu-Batch-Variationen zurückzuführen. * Versand bei Raumtemperatur (Stabilitätstests zeigen, dass dieses Produkt ohne Kühlmaßnahmen versendet werden kann.) |
|||||||||||
Vorbereitung von Stammlösungen
Biologische Aktivität
| Beschreibung | Orantinib (SU6668) zeigt die größte Wirksamkeit gegen die PDGFR-Autophosphorylierung mit einem Ki von 8 nM in einem zellfreien Assay, hemmt aber auch stark die Flk-1- und FGFR1-Transphosphorylierung. Es zeigt wenig Aktivität gegen IGF-1R, Met, Src, Lck, Zap70, Abl und CDK2 und hemmt EGFR nicht. Diese Verbindung befindet sich in Phase 3. | ||
|---|---|---|---|
| Ziele |
|
||
| In vitro | Orantinib (SU6668) ist ein kompetitiver Inhibitor, in Bezug auf ATP, der Flk-1/KDR-Transphosphorylierung, FGFR1-Transphosphorylierung und PDGFRβ-Kinase-Autophosphorylierung. Es (0,03-10 μM) hemmt die Tyrosinphosphorylierung von KDR in VEGF-stimulierten HUVECs. Diese Verbindung hemmt auch die PDGF-stimulierte PDGFRβ-Tyrosinphosphorylierung in NIH-3T3-Zellen, die PDGFRβ überexprimieren, bei einer Mindestkonzentration von 0,03-0,1 μM. Es hemmt die saures FGF-induzierte Phosphorylierung des FGFR1-Substrats 2 bei 10 μM und höher. Allerdings hat TSU-68 (bis zu 100 μM) keine Wirkung auf die EGF-stimulierte EGFR-Tyrosinphosphorylierung in NIH-3T3-Zellen, die EGFR überexprimieren. Es hemmt die VEGF-getriebene und FGF-getriebene Mitogenese von HUVECs mit mittleren IC50-Werten von 0,34 μM bzw. 9,6 μM. In menschlichen myeloischen Leukämie-MO7E-Zellen hemmt diese Verbindung die Tyrosin-Autophosphorylierung des Stammzellfaktor-(SCF)-Rezeptors, c-kit, mit einer IC50 von 0,1-1 μM, sowie die ERK1/2-Phosphorylierung, ein Signalereignis nach der c-kit-Aktivierung. Es hemmt auch die SCF-induzierte Proliferation von MO7E-Zellen mit einer IC50 von 0,29 μM und induziert Apoptose. | ||
| In vivo | Orantinib (SU6668) induziert eine Tumorwachstumsinhibition gegen ein breites Spektrum von Tumortypen in Xenograft-Modellen an athymischen Mäusen, einschließlich A375-, Colo205-, H460-, Calu-6-, C6-, SF763T- und SKOV3TP5-Zellen bei Dosen von 75-200 mg/kg. Diese Verbindung (75 mg/kg) unterdrückt auch die Tumorangiogenese von C6-Gliom-Xenografts. In einem Tumormodell des HT29-Kolonkarzinoms beim Menschen verringert es (200 mg/kg) die durchschnittliche Gefäßpermeabilität und das durchschnittliche fraktionierte Plasmavolumen im Tumorrand und -kern. TSU-68 fördert eine abnormale Stromabildung an der Peripherie von Karzinomen. In einem Kaninchen-VX2-Lebertumormodell verstärkt es (200 mg/kg) die Wirkung der Chemotherapieinfusion. |
Protokoll (aus Referenz)
| Kinase-Assay: |
|
|---|---|
| Zell-Assay: |
|
| Tierstudie: |
|
Referenzen
|
Kundenproduktvalidierung
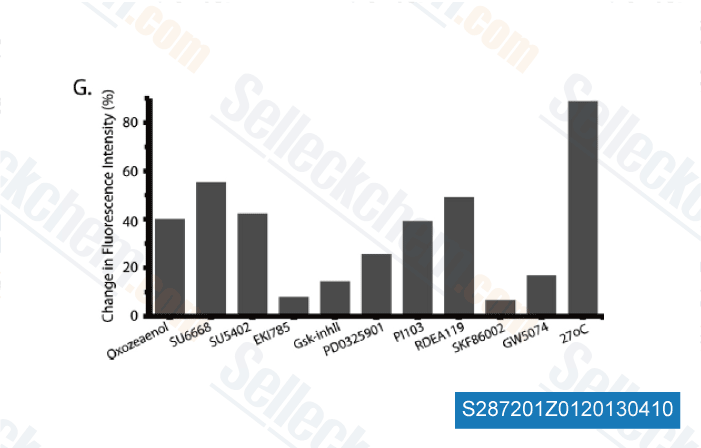
-
Daten von [ Mol Cell Proteomics , 2012 ]

-
Daten von [ Mol Cell Proteomics , 2012 ]
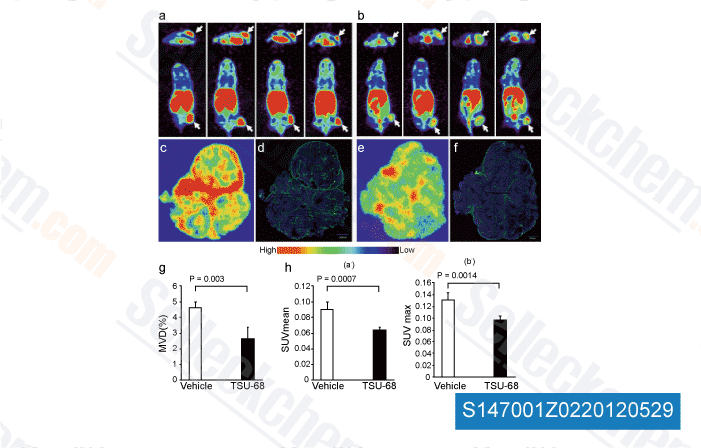
-
Daten von [ Angiogenesis , 2012 , 15, 569-80 ]
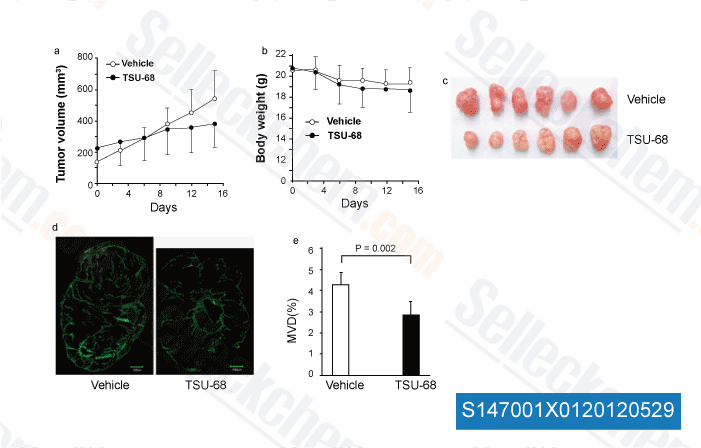
-
Daten von [ Angiogenesis , 2012 , 15, 569-80 ]
Sellecks Orantinib (SU6668) Wurde zitiert von 21 Publikationen
| SMYD5 is a novel epigenetic gatekeeper of the mild hypothermia response [ bioRxiv, 2023, 2023.05.11.540170] | PubMed: 37333301 |
| Establishment and Characterization of NCC-PMP1-C1: A Novel Patient-Derived Cell Line of Metastatic Pseudomyxoma Peritonei [ J Pers Med, 2022, 12(2)258] | PubMed: 35207746 |
| Establishment and characterization of NCC-UPS4-C1: a novel cell line of undifferentiated pleomorphic sarcoma from a patient with Li-Fraumeni syndrome [ Hum Cell, 2022, 10.1007/s13577-022-00671-y] | PubMed: 35118583 |
| Establishment and characterization of NCC-MFS4-C1: a novel patient-derived cell line of myxofibrosarcoma [ Hum Cell, 2021, 34(6):1911-1918] | PubMed: 34383271 |
| Establishment and characterization of the NCC-GCTB4-C1 cell line: a novel patient-derived cell line from giant cell tumor of bone [ Hum Cell, 2021, 10.1007/s13577-021-00639-4] | PubMed: 34731453 |
| Establishment and characterization of novel patient-derived cell lines from giant cell tumor of bone [ Hum Cell, 2021, 10.1007/s13577-021-00579-z] | PubMed: 34304386 |
| The Meningioma Enhancer Landscape Delineates Novel Subgroups and Drives Druggable Dependencies [ Cancer Discov, 2020, CD-20-0160] | PubMed: 32703768 |
| Establishment and characterization of NCC-MFS2-C1: a novel patient-derived cancer cell line of myxofibrosarcoma [ Hum Cell, 2020, 10.1007/s13577-020-00420-z] | PubMed: 32870449 |
| Multi-omic Profiling Reveals Dynamics of the Phased Progression of Pluripotency. [ Cell Syst, 2019, 8(5):427-445] | PubMed: 31078527 |
| Intratumoural Heterogeneity Underlies Distinct Therapy Responses and Treatment Resistance in Glioblastoma. [ Cancers (Basel), 2019, 11(2)] | PubMed: 30736342 |
RÜCKGABERICHTLINIE
Die bedingungslose Rückgaberichtlinie von Selleck Chemical gewährleistet unseren Kunden ein reibungsloses Online-Einkaufserlebnis. Wenn Sie in irgendeiner Weise mit Ihrem Kauf unzufrieden sind, können Sie jeden Artikel innerhalb von 7 Tagen nach Erhalt zurückgeben. Im Falle von Produktqualitätsproblemen, sei es protokollbezogene oder produktbezogene Probleme, können Sie jeden Artikel innerhalb von 365 Tagen ab dem ursprünglichen Kaufdatum zurückgeben. Bitte befolgen Sie die nachstehenden Anweisungen, wenn Sie Produkte zurücksenden.
VERSAND UND LAGERUNG
Selleck-Produkte werden bei Raumtemperatur transportiert. Wenn Sie das Produkt bei Raumtemperatur erhalten, seien Sie versichert, dass die Qualitätskontrollabteilung von Selleck Experimente durchgeführt hat, um zu überprüfen, dass die normale Temperaturplatzierung von einem Monat die biologische Aktivität von Pulverprodukten nicht beeinträchtigt. Nach dem Sammeln lagern Sie das Produkt bitte gemäß den in der Datenblatt beschriebenen Anforderungen. Die meisten Selleck-Produkte sind unter den empfohlenen Bedingungen stabil.
NICHT FÜR DIE ANWENDUNG AM MENSCHEN, FÜR VETERINÄRMEDIZINISCHE DIAGNOSTIK ODER THERAPEUTISCHE ZWECKE.
