Technische Daten
| Formel | C23H28N8OS |
||||||
| Molekulargewicht | 464.59 | CAS-Nr. | 639089-54-6 | ||||
| Löslichkeit (25°C)* | In vitro | DMSO | 93 mg/mL (200.17 mM) | ||||
| Ethanol | 40 mg/mL (86.09 mM) | ||||||
| Water | Insoluble | ||||||
| In vivo (Lösungsmittel einzeln und der Reihe nach zum Produkt hinzufügen.) |
|
||||||
|
* <1 mg/ml bedeutet schwer löslich oder unlöslich. * Bitte beachten Sie, dass Selleck die Löslichkeit aller Verbindungen intern testet und die tatsächliche Löslichkeit geringfügig von veröffentlichten Werten abweichen kann. Dies ist normal und ist auf geringfügige Batch-zu-Batch-Variationen zurückzuführen. * Versand bei Raumtemperatur (Stabilitätstests zeigen, dass dieses Produkt ohne Kühlmaßnahmen versendet werden kann.) |
|||||||
Vorbereitung von Stammlösungen
Biologische Aktivität
| Beschreibung | Tozasertib (VX-680) ist ein Pan-Aurora-Inhibitor, der hauptsächlich gegen Aurora A mit einem Kiapp von 0,6 nM in einem zellfreien Assay wirkt, weniger potent gegenüber Aurora B/Aurora C und 100-fach selektiver für Aurora A als 55 andere Kinasen ist. Die einzigen Ausnahmen sind Fms-related tyrosine kinase-3 (FLT-3) und BCR-ABL tyrosine kinase, die von dieser Verbindung mit einem Ki von 30 nM gehemmt werden. Es induziert apoptosis und autophagy und befindet sich in Phase 2. | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Ziele |
|
||||||||||
| In vitro | Obwohl Tozasertib (VX-680) ein Multi-Kinase-Profil aufweist, induziert es eine ähnliche Zytotoxizität mit einer IC50 von ca. 300 nM und zeigt einen AUR B-ähnlichen inhibitorischen Phänotyp von G2/M-Arrest, Endoreduplikation und Apoptose in BaF3-Zellen, die mit ABL- oder FLT-3-Kinasen (mutiert und Wildtyp) transfiziert wurden. Diese Verbindung verhindert die CAL-62-Proliferation zeitabhängig. Eine 14-tägige Behandlung verringert die Anzahl und Größe der Kolonien um etwa 70 % in den 8305C und 90 % in den CAL-62, 8505C und BHT-101. Die Behandlung der verschiedenen ATC-Zellen damit hemmt die Proliferation mit einer IC50 zwischen 25 und 150 nM. Es beeinträchtigt signifikant die Fähigkeit der verschiedenen Zelllinien, Kolonien in Weichagar zu bilden. Die Analyse der Caspase-3-Aktivität zeigt, dass VX-680 Apoptose in den verschiedenen Zelllinien induziert. CAL-62-Zellen, die 12 Stunden lang der Verbindung ausgesetzt waren, zeigten eine Akkumulation von Zellen mit ≥4N DNA-Gehalt. Die Zeitrafferanalyse zeigt, dass behandelte CAL-62-Zellen die Metaphase ohne Teilung verlassen. Darüber hinaus wird die Histon-H3-Phosphorylierung nach der Behandlung aufgehoben. Es besitzt eine signifikante hemmende Aktivität gegen BCR-Abl mit der T315I-Mutation in patientenabgeleiteten Proben. | ||||||||||
| In vivo | Tozasertib (VX-680) führt zu einer deutlichen Verringerung der Tumorgröße in einem humanen AML (HL-60) Xenograft-Modell. In Nacktmäusen, die mit 75 mg/kg zweimal täglich intraperitoneal (b.i.d. i.p.) über 13 Tage behandelt wurden, wurden die mittleren Tumorvolumina um 98 % reduziert. Die Tumorwachstumsreduktion ist dosisabhängig und signifikant bei einer Dosis von 12,5 mg/kg b.i.d. Diese Verbindung wird gut vertragen, wobei eine geringe Abnahme des Körpergewichts nur bei der höchsten Dosis beobachtet wurde. Sie löst auch die Tumorregression in Pankreas- und Kolon-Xenograft-Modellen aus. Tozasertib zeigt auch eine potente Antitumoraktivität, wenn es i.v. in Nacktratten mit etablierten HCT116-Tumoren infundiert wird. Eine höhere Dosis (2 mg/kg/h) verbessert die Wirksamkeit mit einer 56%igen Abnahme des mittleren Tumorvolumens. |
Protokoll (aus Referenz)
| Kinase-Assay: |
|
|---|---|
| Zell-Assay: |
|
| Tierstudie: |
|
Referenzen
|
Kundenproduktvalidierung
-
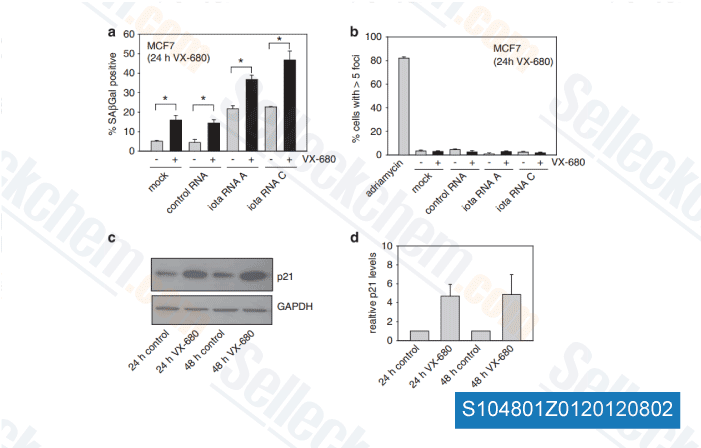
Daten von [ Oncogene , 2012 , 31, 3584-96 ]

-
Daten von [ Oncogene , 2012 , 31, 3584-96 ]
-
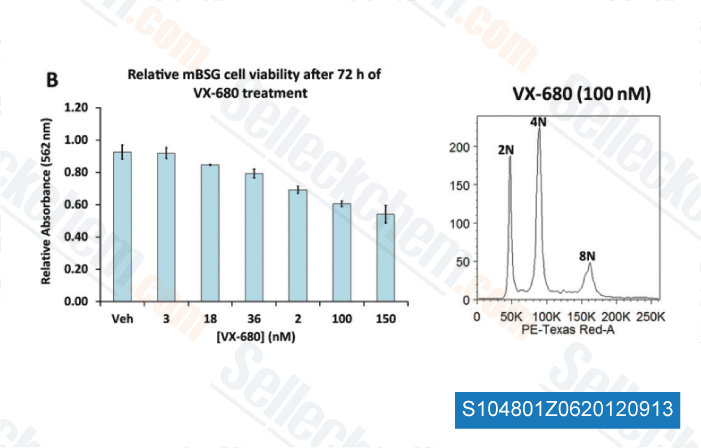
Daten von [ Brain Pathol , 2012 , 23, 244-53 ]
-
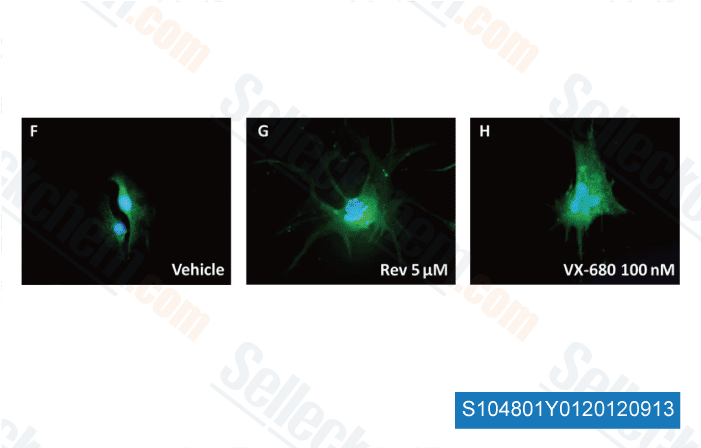
Daten von [ Brain Pathol , 2012 , 23, 244-53 ]
Sellecks Tozasertib (VX-680) Wurde zitiert von 139 Publikationen
| A patient-derived T cell lymphoma biorepository uncovers pathogenetic mechanisms and host-related therapeutic vulnerabilities [ Cell Rep Med, 2025, S2666-3791(25)00102-8] | PubMed: 40147445 |
| Overcoming MET-targeted drug resistance in MET-amplified lung cancer by aurora kinase B inhibition [ Biochim Biophys Acta Mol Cell Res, 2025, 1872(7):120001] | PubMed: 40499687 |
| Hedgehog signalling is involved in acquired resistance to KRASG12C inhibitors in lung cancer cells [ Cell Death Dis, 2024, 15(1):56] | PubMed: 38225225 |
| Dynamic phosphorylation of FOXA1 by Aurora B guides post-mitotic gene reactivation [ Cell Rep, 2024, 43(9):114739] | PubMed: 39276350 |
| The molecular basis of Abelson kinase regulation by its αI-helix [ Elife, 2024, 12RP92324] | PubMed: 38588001 |
| Tozasertib activates anti-tumor immunity through decreasing regulatory T cells in melanoma [ Neoplasia, 2024, 48:100966] | PubMed: 38237304 |
| Machine learning based androgen receptor regulatory gene-related random forest survival model for precise treatment decision in prostate cancer [ Heliyon, 2024, 10(17):e37256] | PubMed: 39296076 |
| Visualization strategies to aid interpretation of high-dimensional genotoxicity data [ Environ Mol Mutagen, 2024, 10.1002/em.22604] | PubMed: 38757760 |
| Molecular landscape and functional characterization of centrosome amplification in ovarian cancer [ Nat Commun, 2023, 14(1):6505] | PubMed: 37845213 |
| Mitotic Dysregulation at Tumor Initiation Creates a Therapeutic Vulnerability to Combination Anti-Mitotic and Pro-Apoptotic Agents for MYCN-Driven Neuroblastoma [ Int J Mol Sci, 2023, 10.3390/ijms242115571] | PubMed: 37958555 |
RÜCKGABERICHTLINIE
Die bedingungslose Rückgaberichtlinie von Selleck Chemical gewährleistet unseren Kunden ein reibungsloses Online-Einkaufserlebnis. Wenn Sie in irgendeiner Weise mit Ihrem Kauf unzufrieden sind, können Sie jeden Artikel innerhalb von 7 Tagen nach Erhalt zurückgeben. Im Falle von Produktqualitätsproblemen, sei es protokollbezogene oder produktbezogene Probleme, können Sie jeden Artikel innerhalb von 365 Tagen ab dem ursprünglichen Kaufdatum zurückgeben. Bitte befolgen Sie die nachstehenden Anweisungen, wenn Sie Produkte zurücksenden.
VERSAND UND LAGERUNG
Selleck-Produkte werden bei Raumtemperatur transportiert. Wenn Sie das Produkt bei Raumtemperatur erhalten, seien Sie versichert, dass die Qualitätskontrollabteilung von Selleck Experimente durchgeführt hat, um zu überprüfen, dass die normale Temperaturplatzierung von einem Monat die biologische Aktivität von Pulverprodukten nicht beeinträchtigt. Nach dem Sammeln lagern Sie das Produkt bitte gemäß den in der Datenblatt beschriebenen Anforderungen. Die meisten Selleck-Produkte sind unter den empfohlenen Bedingungen stabil.
NICHT FÜR DIE ANWENDUNG AM MENSCHEN, FÜR VETERINÄRMEDIZINISCHE DIAGNOSTIK ODER THERAPEUTISCHE ZWECKE.
