Technische Daten
| Formel | C22H24BrFN4O2 |
||||||
| Molekulargewicht | 475.35 | CAS-Nr. | 443913-73-3 | ||||
| Löslichkeit (25°C)* | In vitro | DMSO | 38 mg/mL (79.94 mM) | ||||
| Water | Insoluble | ||||||
| Ethanol | Insoluble | ||||||
| In vivo (Lösungsmittel einzeln und der Reihe nach zum Produkt hinzufügen.) |
|
||||||
|
* <1 mg/ml bedeutet schwer löslich oder unlöslich. * Bitte beachten Sie, dass Selleck die Löslichkeit aller Verbindungen intern testet und die tatsächliche Löslichkeit geringfügig von veröffentlichten Werten abweichen kann. Dies ist normal und ist auf geringfügige Batch-zu-Batch-Variationen zurückzuführen. * Versand bei Raumtemperatur (Stabilitätstests zeigen, dass dieses Produkt ohne Kühlmaßnahmen versendet werden kann.) |
|||||||
Vorbereitung von Stammlösungen
Biologische Aktivität
| Beschreibung | Vandetanib ist ein potenter Inhibitor von VEGFR2 mit einer IC50 von 40 nM in einem zellfreien Assay. Es hemmt auch VEGFR3 und EGFR mit IC50-Werten von 110 nM bzw. 500 nM. Es ist nicht empfindlich gegenüber PDGFRβ, Flt1, Tie-2 und FGFR1 mit einer IC50 von 1,1-3,6 μM. Keine Aktivität gegen MEK, CDK2, c-Kit, erbB2, FAK, PDK1, Akt und IGF-1R mit einer IC50 über 10 μM. Diese Verbindung erhöht die Apoptose und induziert Autophagy durch Erhöhung des Spiegels von reaktiven Sauerstoffspezies (ROS). | ||||||
|---|---|---|---|---|---|---|---|
| Ziele |
|
||||||
| In vitro | Vandetanib hemmt auch VEGFR3 und EGFR mit IC50-Werten von 110 nM bzw. 500 nM. Diese Verbindung ist nicht empfindlich gegenüber PDGFRβ, Flt1, Tie-2 und FGFR1 mit einer IC50 von 1,1-3,6 μM, während sie fast keine Aktivität gegen MEK, CDK2, c-Kit, erbB2, FAK, PDK1, Akt und IGF-1R mit einer IC50 über 10 μM aufweist. Es hemmt die VEGF-, EGF- und bFGF-stimulierte HUVEC-Proliferation mit IC50-Werten von 60 nM, 170 nM und 800 nM, ohne Auswirkung auf das basale Endothelzellwachstum. Diese Chemikalie hemmt das Tumorzellwachstum mit einer IC50 von 2,7 μM (A549) bis 13,5 μM (Calu-6). Es zeigt eine hemmende Wirkung auf die basale ABCG2-ATPase. Parentale und ABCG2-exprimierende A431-Zellen zeigten ähnliche Empfindlichkeiten gegenüber dieser Verbindung. Die Exposition gegenüber EGFR-Inhibitoren verringert die pEGFR-Spiegel in A431-Zellen, wobei diese Verbindung nur einen moderaten Effekt zeigt. Es zeigt einen geringen, aber messbaren Effekt, während Gefitinib, Pelitinib und Neratinib den ABCG2-vermittelten Mitoxantron-Efflux aus A431/ABCG2-Zellen vollständig hemmen, ähnlich dem spezifischen ABCG2-Inhibitor Ko143. Es hemmt sowohl PC3wt- als auch PC3R-Zelllinien mit ähnlichen IC50-Werten von 13,3 μM bzw. 11,5 μM. Diese Chemikalie unterdrückt die Phosphorylierung von VEGFR2 in HUVEC und EGFR in Hepatomzellen und hemmt die Zellproliferation. Es führt zu einer Akkumulation von Zellen in den G0-G1-Phasen in GEO- und OVCAR-3-Zellen und erhöht die Apoptose in OVCAR-3-, ZR-75-1-, MCF-10A-ras- und GEO-Zellen. Diese Verbindung verursacht eine dosisabhängige Hemmung der EGFR-Phosphorylierung in Maus-NIH-EGFR-Fibroblasten und menschlichen MCF-10A-ras-Brustkrebszellen, zwei Zelllinien, die den menschlichen EGFR überexprimieren. Die Behandlung führt zu einer dosisabhängigen Hemmung des Weichagarwachstums in sieben menschlichen Zelllinien (Brust, Kolon, Magen und Eierstöcke) mit funktionellem EGFR, aber ohne VEGFR2. | ||||||
| In vivo | Vandetanib (2,5 mg/kg, i.v.) kehrt eine VEGF-induzierte Hypotonie um 63% um, beeinflusst aber eine bFGF-induzierte Hypotonie nicht signifikant. Diese Verbindung (100 mg/kg) hemmt die tumorinduzierte Blutgefäßbildung um 79%. Es (12,5-100 mg/kg, oral) zeigt eine starke Hemmung des Tumorwachstums in menschlichen Tumor-Xenografts, einschließlich Calu-6, PC-3, MDA-MA-231, SKOV-3, SW620, A549, A431, B16-F10(AP3) und Lewis Lung, mit geringen Auswirkungen auf das Körpergewicht. In PC3wt-Xenografts übt die Verabreichung dieser Verbindung allein paradoxe tumorwachstumsstimulierende Effekte aus. In PC3R-Xenografts hat die niedrige Dosis dieser Chemikalie (25 mg/kg) keinen signifikanten Effekt im Vergleich zur Kontrolle, während die hohe Dosis (50 mg/kg) das Tumorwachstum im Vergleich zur Kontrolle signifikant hemmt. Im Gegensatz dazu zeigt die Hochdosis-Kombination eine signifikante negative Wechselwirkung zwischen dieser Verbindung 50 mg/kg und Docetaxel 30 mg/kg in PC3R-Zellen. In tumortragenden Mäusen unterdrückt es die Phosphorylierung von VEGFR2 und EGFR in Tumorgeweben, verringert die Tumorgefäßdichte signifikant, verstärkt die Tumorzell-Apoptose, unterdrückt das Tumorwachstum, verbessert das Überleben, reduziert die Anzahl intrahepatischer Metastasen und reguliert VEGF, TGF-alpha und EGF in Tumorgeweben hoch. Die Behandlung mit dieser Verbindung ist nicht mit schwerwiegenden unerwünschten Ereignissen verbunden, einschließlich ALT-Anomalien, Knochenmarksuppression oder Gewichtsverlust. Die Behandlung von Nacktmäusen mit tastbaren GEO-Kolonkarzinom-Xenografts (die empfindlich auf die Hemmung der EGFR-Signalübertragung reagieren) mit dieser Chemikalie induziert eine dosisabhängige Hemmung des Tumorwachstums. |
Protokoll (aus Referenz)
| Kinase-Assay: |
|
|---|---|
| Zell-Assay: |
|
| Tierstudie: |
|
Referenzen
|
Kundenproduktvalidierung
![<p>Vandetanib reduced extracellular nitrite levels in endothelial cells. MS1 endothelial cells (ECs) were incubated with 1 mol/L of vandetanib or matched vehicle (dimethyl sulfoxide [DMSO]), 50 ng/mL of vascular endothelial growth factor (VEGF) or matched vehicle (PBS; 0.5 hours), and L-arginine and soluble N-ethylmaleamide sensitive factor attachment protein (SNAP) added (1.5 hours). Vandetanib lowered nitrite levels in MS1 Ecs (*P0.0003). VEGF was used a positive control and increased nitrite levels (**P0.02). These findings indicate that vandetanib lowered endothelial cell NO levels.</p>](https://file.selleckchem.com/downloads/review/700px/Vandetanib-Zactima-S104601Z0220100601.gif)
-
Daten von [ Hypertension , 2011 , 58, 85-92 ]
![<p>Vandetanib reduced phosphorylation of Akt in endothelial cells (ECs). MS1 ECs were incubated with 1 μmol/L of vandetanib or matched vehicle (dimethyl sulfoxide [DMSO]; 1 hour). Western blotting analysis showed that vandetanib decreased phosphorylation of Akt (S473) in MS1 ECs (*P<0.01; n=6 per group, studies done in triplicate). These findings show that vandetanib reduced Akt activity.</p>](https://file.selleckchem.com/downloads/review/700px/Vandetanib-Zactima-S104601W0320100601.gif)
-
Daten von [ Hypertension , 2011 , 58, 85-92 ]
![<p>Vandetanib increases membrane localization of endothelial NO synthase (eNOS). MS1 endothelial cells (ECs) were incubated with 1 μmol/L of vandetanib or matched vehicle (dimethyl sulfoxide [DMSO]). Western blotting analysis showed that vandetanib increases membrane localization of eNOS compared with control (*P<0.04; n=4 per group, studies done in triplicate). These findings show that vandetanib increased the membrane localization of eNOS compared with control.</p>](https://file.selleckchem.com/downloads/review/700px/Vandetanib-Zactima-S104601Z0420100601.gif)
-
Daten von [ Hypertension , 2011 , 58, 85-92 ]
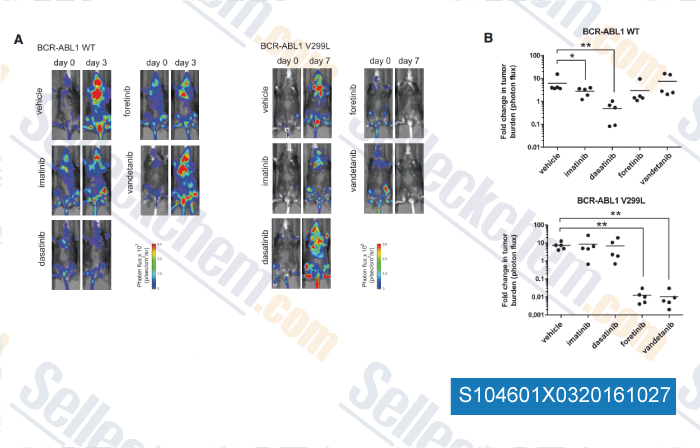
-
, , Cell, 2016, 165(1):234-46.
Sellecks Vandetanib Wurde zitiert von 118 Publikationen
| Ponatinib and other clinically approved inhibitors of Src and Rho-A kinases abrogate dengue virus serotype 2- induced endothelial permeability [ Virulence, 2025, 16(1):2489751] | PubMed: 40189910 |
| Kinase Plasticity in Response to Vandetanib Enhances Sensitivity to Tamoxifen in Estrogen Receptor Positive Breast Cancer [ bioRxiv, 2025, 2024.12.19.629395] | PubMed: 39975402 |
| CAVIN1-Mediated hERG Dynamics: A Novel Mechanism Underlying the Interindividual Variability in Drug-Induced Long QT [ Circulation, 2024, 150(7):563-576] | PubMed: 38682330 |
| Novel therapeutic strategies targeting bypass pathways and mitochondrial dysfunction to combat resistance to RET inhibitors in NSCLC [ Biochim Biophys Acta Mol Basis Dis, 2024, 1870(6):167249] | PubMed: 38768929 |
| Patient-derived rhabdomyosarcoma cells recapitulate the genetic and transcriptomic landscapes of primary tumors [ iScience, 2024, 27(10):110862] | PubMed: 39319271 |
| Vandetanib as a prospective anti-inflammatory and anti-contractile agent in asthma [ Front Pharmacol, 2024, 15:1345070] | PubMed: 38799165 |
| ETV2 primes hematoendothelial gene enhancers prior to hematoendothelial fate commitment [ Cell Rep, 2023, 42(6):112665] | PubMed: 37330911 |
| Nuclear translocation of cGAS orchestrates VEGF-A-mediated angiogenesis [ Cell Reports, 2023, 112328] | PubMed: None |
| Nuclear translocation of cGAS orchestrates VEGF-A-mediated angiogenesis [ Cell Rep, 2023, 42(4):112328] | PubMed: 37027305 |
| Phosphate-induced activation of VEGFR2 leads to caspase-9-mediated apoptosis of hypertrophic chondrocytes [ iScience, 2023, 26(9):107548] | PubMed: 37636062 |
RÜCKGABERICHTLINIE
Die bedingungslose Rückgaberichtlinie von Selleck Chemical gewährleistet unseren Kunden ein reibungsloses Online-Einkaufserlebnis. Wenn Sie in irgendeiner Weise mit Ihrem Kauf unzufrieden sind, können Sie jeden Artikel innerhalb von 7 Tagen nach Erhalt zurückgeben. Im Falle von Produktqualitätsproblemen, sei es protokollbezogene oder produktbezogene Probleme, können Sie jeden Artikel innerhalb von 365 Tagen ab dem ursprünglichen Kaufdatum zurückgeben. Bitte befolgen Sie die nachstehenden Anweisungen, wenn Sie Produkte zurücksenden.
VERSAND UND LAGERUNG
Selleck-Produkte werden bei Raumtemperatur transportiert. Wenn Sie das Produkt bei Raumtemperatur erhalten, seien Sie versichert, dass die Qualitätskontrollabteilung von Selleck Experimente durchgeführt hat, um zu überprüfen, dass die normale Temperaturplatzierung von einem Monat die biologische Aktivität von Pulverprodukten nicht beeinträchtigt. Nach dem Sammeln lagern Sie das Produkt bitte gemäß den in der Datenblatt beschriebenen Anforderungen. Die meisten Selleck-Produkte sind unter den empfohlenen Bedingungen stabil.
NICHT FÜR DIE ANWENDUNG AM MENSCHEN, FÜR VETERINÄRMEDIZINISCHE DIAGNOSTIK ODER THERAPEUTISCHE ZWECKE.
