Technische Daten
| Formel | C30H30O8.C2H4O2 |
||||||
| Molekulargewicht | 578.61 | CAS-Nr. | 866541-93-7 | ||||
| Löslichkeit (25°C)* | In vitro | DMSO | 116 mg/mL (200.48 mM) | ||||
| Ethanol | 89 mg/mL (153.81 mM) | ||||||
| Water | Insoluble | ||||||
| In vivo (Lösungsmittel einzeln und der Reihe nach zum Produkt hinzufügen.) |
|
||||||
|
* <1 mg/ml bedeutet schwer löslich oder unlöslich. * Bitte beachten Sie, dass Selleck die Löslichkeit aller Verbindungen intern testet und die tatsächliche Löslichkeit geringfügig von veröffentlichten Werten abweichen kann. Dies ist normal und ist auf geringfügige Batch-zu-Batch-Variationen zurückzuführen. * Versand bei Raumtemperatur (Stabilitätstests zeigen, dass dieses Produkt ohne Kühlmaßnahmen versendet werden kann.) |
|||||||
Vorbereitung von Stammlösungen
Biologische Aktivität
| Beschreibung | (R)-(-)-Gossypol (AT-101)-Essigsäure, das R-(-)-Enantiomer der Gossypol-Essigsäure, bindet an Bcl-2, Bcl-xL und Mcl-1 mit Ki von 0,32 μM, 0,48 μM und 0,18 μM in zellfreien Assays; hemmt nicht die BIR3-Domäne und BID. AT-101 löst gleichzeitig Apoptose und eine zytoprotektive Art von Autophagy aus. Phase 2. | ||||||
|---|---|---|---|---|---|---|---|
| Ziele |
|
||||||
| In vitro | AT-101 hemmt eine Reihe verschiedener lymphoproliferativer Malignome mit IC50-Werten von 1,2 μM bis 7,4 μM. AT-101 (10 μM) stört das Δψm in einer konzentrations- und zeitabhängigen Weise in einer diffusen großzelligen B-Zell- und in Mantelzell-Lymphomlinien. AT-101 (1 μM oder 2 μM) in Kombination mit Carfilzomib (6 nM oder 10 nM) induziert Apoptosis in HBL-2- und Granta-Zelllinien. AT-101 (20 μM für 24 Stunden) führt zu einer medianen Apoptosis von 72 % und einer Herunterregulierung von Mcl-1 in CLL-Lymphozyten sowohl in Suspensionskultur als auch in Stromazell-Kokultur. Stromazellen exprimieren nicht nachweisbare Spiegel von Anti-Apoptosis, aber hohe Spiegel von aktivierten ERK- und AKT-Proteinen und zeigen eine geringe oder keine Apoptosis mit AT-101. AT-101 induziert Apoptosis in einer zeit- und dosisabhängigen Weise, mit ED50-Werten von 1,9 mM bzw. 2,4 mM in Jurkat T- und U937-Zellen. AT-101 (10 μM) in Kombination mit Strahlung (32 Gy) induziert mehr Apoptosis als Strahlung allein und übertrifft die Summe der Effekte, die durch die Einzelwirkstoffbehandlungen verursacht werden. AT-101 aktiviert SAPK/JNK in einer dosis- und zeitabhängigen Weise. AT-101 (10 µM) induziert Apoptosis durch Aktivierung von Caspase-9, -3 und -7 in VCaP-Zellen. AT-101 (10 µM) verringert die Bcl-2- und Mcl-1-Expression in VCaP-Zellen. AT-101 (< 20 μM) ist in der Lage, das Wachstum von multiplen Myelomzellen zu hemmen, trotz der stimulierenden Wachstumseffekte, die von Stromazellen im Knochenmarkmilieu bereitgestellt werden. AT-101 (10 μM) induziert Apoptosis in multiplen Myelomzellen über die Aktivierung von Caspasen 3, Caspasen 9 und PARP. AT-101 (10 μM) fördert Apoptosis in multiplen Myelomzellen, indem es das Bax/Bcl-2-Verhältnis und das mitochondriale Membranpotential stört. | ||||||
| In vivo | AT-101 ist im Plasma mit durchschnittlichen Konzentrationen von 0,49 μM für die 35 mg/kg-Gruppe und 0,39 μM für die 200 mg/kg-Gruppe in SCID-Beige-Mäusen mit RL-DLBCL-Xenograft immer noch nachweisbar. Die maximale Plasmakonzentration von AT-101 wird nach 30 Minuten der Verabreichung des Medikaments bei beiden Dosisstufen beobachtet, wobei die 200 mg/kg-Gruppe eine durchschnittliche Plasmakonzentration aufweist, die fast 4-mal höher ist als die der 35 mg/kg-Gruppe (7,88 μM bzw. 27,78 μM) in SCID-Beige-Mäusen. AT-101 (25 mg/kg bis 100 mg/kg, oral) führt auf unbestimmte Zeit zu einem früheren Beginn des Gewichtsverlusts, der mehr als 10 % des Vorbehandlungsgewichts entspricht, und zum Tod bei SCID-Beige-Mäusen. AT-101 (35 mg/kg, oral pro Tag für 10 Tage) plus intraperitoneales Cyclophosphamid (Cy) und intraperitoneales Rituximab (R) zeigen eine signifikante Tumorkontrolle im Vergleich zu jeder anderen Behandlungsgruppe. AT-101 (15 mg/kg, p.o., 5 Tage/Woche) als Einzelwirkstoff in intakten Mäusen reduziert signifikant die Entwicklung des VCaP-Tumorwachstums im Vergleich zu unbehandelten Tumoren in den Wochen 2 bis 6. AT-101 in Kombination mit chirurgischer Kastration verzögert den Beginn des androgenunabhängigen VCaP-Tumorwachstums im Vergleich zu den Gruppen nur mit Kastration oder nur mit AT-101 bei Mäusen. |
Protokoll (aus Referenz)
| Kinase-Assay:[1] |
|
|---|---|
| Zell-Assay:[2] |
|
| Tierstudie:[2] |
|
Referenzen
|
Kundenproduktvalidierung
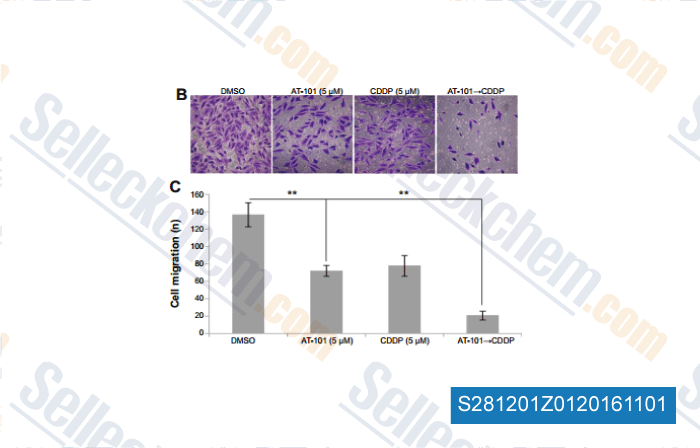
-
, , Drug Des Devel Ther, 2014, 8:2517-29.
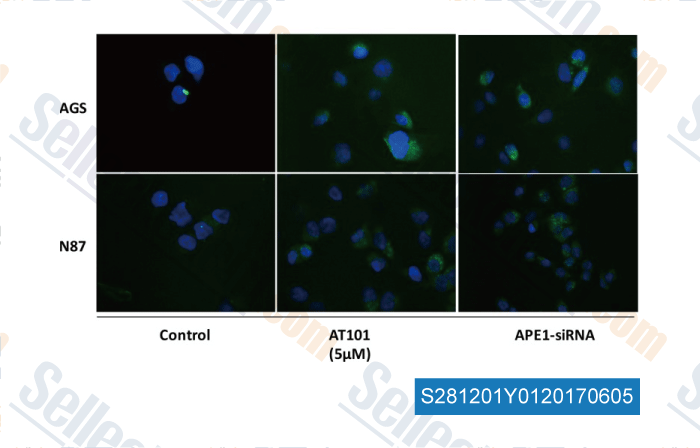
-
Daten von [ , , Oncotarget, 2016, 7(23):34430-41 ]
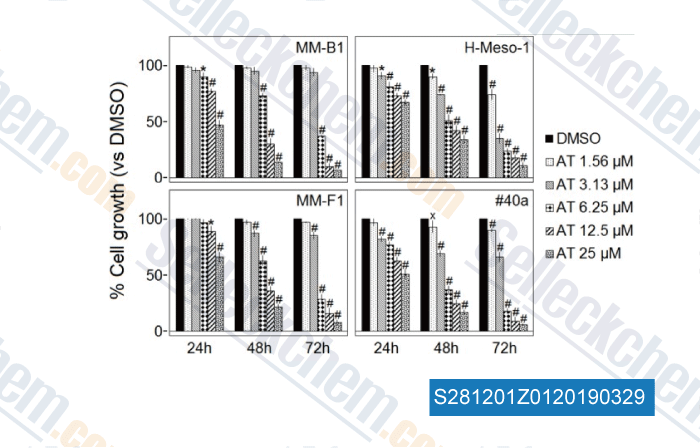
-
Daten von [ , , Front Pharmacol, 2018, 9:1269 ]
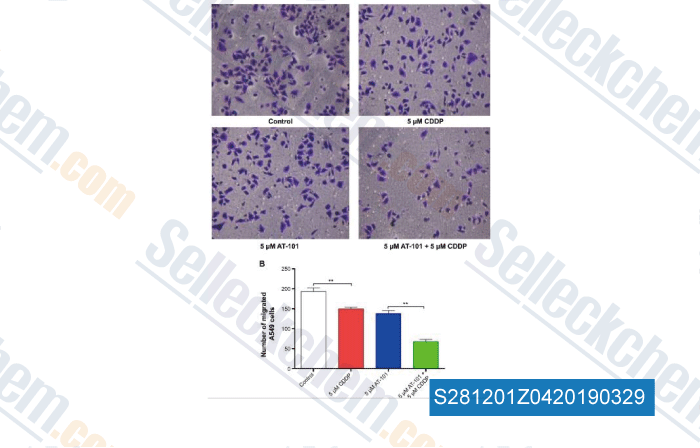
-
Daten von [ , , Drug Des Devel Ther, 2015, 9:2887-910 ]
Sellecks (R)-(-)-Gossypol (AT-101) acetic acid Wurde zitiert von 20 Publikationen
| Follicle stimulating hormone controls granulosa cell glutamine synthesis to regulate ovulation [ Protein Cell, 2024, pwad065] | PubMed: 38167949 |
| Pharmacological Targeting of Bcl-2 Induces Caspase 3-Mediated Cleavage of HDAC6 and Regulates the Autophagy Process in Colorectal Cancer [ Int J Mol Sci, 2023, 24(7)6662] | PubMed: 37047634 |
| Exploiting ulnerabilities induced b recurrent mutations in chondrosarcoma and giant cell tumour of bone: therapeutic targeting of the altered epigenome and be [ Leiden University The Netherlands, 2023, ] | PubMed: None |
| Integrative analysis of drug response and clinical outcome in acute myeloid leukemia [ Cancer Cell, 2022, S1535-6108(22)00312-9] | PubMed: 35868306 |
| Lactate Dehydrogenase B Is Required for Pancreatic Cancer Cell Immortalization Through Activation of Telomerase Activity [ Front Oncol, 2022, 12:821620] | PubMed: 35669414 |
| Gossypol Acetic Acid Attenuates Cardiac Ischemia/Reperfusion Injury in Rats via an Antiferroptotic Mechanism [ Biomolecules, 2021, 11(11)1667] | PubMed: 34827665 |
| AT101 [(-)-Gossypol] Selectively Inhibits MCL1 and Sensitizes Carcinoma to BH3 Mimetics by Inducing and Stabilizing NOXA [ Cancers (Basel), 2020, 12(8):E2298] | PubMed: 32824203 |
| Using CETSA assay and a mathematical model to reveal dual Bcl-2/Mcl-1 inhibition and on-target mechanism for ABT-199 and S1. [ Eur J Pharm Sci, 2020, 142:105105] | PubMed: 31669390 |
| Comparison of putative BH3 mimetics AT-101, HA14-1, sabutoclax and TW-37 with ABT-737 in platelets. [ Platelets, 2020, 10.1080/09537104.2020.1724276] | PubMed: 32079453 |
| Effect of Exosomal APE1 on Sensitivity of NSCLC A549 Cells to Cisplatin [ Cancer Research on Prevention and Treatment, 2020, (7): 492-497] | PubMed: None |
RÜCKGABERICHTLINIE
Die bedingungslose Rückgaberichtlinie von Selleck Chemical gewährleistet unseren Kunden ein reibungsloses Online-Einkaufserlebnis. Wenn Sie in irgendeiner Weise mit Ihrem Kauf unzufrieden sind, können Sie jeden Artikel innerhalb von 7 Tagen nach Erhalt zurückgeben. Im Falle von Produktqualitätsproblemen, sei es protokollbezogene oder produktbezogene Probleme, können Sie jeden Artikel innerhalb von 365 Tagen ab dem ursprünglichen Kaufdatum zurückgeben. Bitte befolgen Sie die nachstehenden Anweisungen, wenn Sie Produkte zurücksenden.
VERSAND UND LAGERUNG
Selleck-Produkte werden bei Raumtemperatur transportiert. Wenn Sie das Produkt bei Raumtemperatur erhalten, seien Sie versichert, dass die Qualitätskontrollabteilung von Selleck Experimente durchgeführt hat, um zu überprüfen, dass die normale Temperaturplatzierung von einem Monat die biologische Aktivität von Pulverprodukten nicht beeinträchtigt. Nach dem Sammeln lagern Sie das Produkt bitte gemäß den in der Datenblatt beschriebenen Anforderungen. Die meisten Selleck-Produkte sind unter den empfohlenen Bedingungen stabil.
NICHT FÜR DIE ANWENDUNG AM MENSCHEN, FÜR VETERINÄRMEDIZINISCHE DIAGNOSTIK ODER THERAPEUTISCHE ZWECKE.
