Technische Daten
| Formel | C26H31Cl2N7O3 |
||||||
| Molekulargewicht | 560.48 | CAS-Nr. | 872511-34-7 | ||||
| Löslichkeit (25°C)* | In vitro | DMSO | 11 mg/mL (19.62 mM) | ||||
| Water | Insoluble | ||||||
| Ethanol | Insoluble | ||||||
| In vivo (Lösungsmittel einzeln und der Reihe nach zum Produkt hinzufügen.) |
|
||||||
|
* <1 mg/ml bedeutet schwer löslich oder unlöslich. * Bitte beachten Sie, dass Selleck die Löslichkeit aller Verbindungen intern testet und die tatsächliche Löslichkeit geringfügig von veröffentlichten Werten abweichen kann. Dies ist normal und ist auf geringfügige Batch-zu-Batch-Variationen zurückzuführen. * Versand bei Raumtemperatur (Stabilitätstests zeigen, dass dieses Produkt ohne Kühlmaßnahmen versendet werden kann.) |
|||||||
Vorbereitung von Stammlösungen
Biologische Aktivität
| Beschreibung | Infigratinib (BGJ398) ist ein potenter und selektiver FGFR-Inhibitor für FGFR1/2/3 mit einem IC50 von 0,9 nM/1,4 nM/1 nM in zellfreien Assays, >40-fach selektiver für FGFR gegenüber FGFR4 und VEGFR2 und geringer Aktivität gegenüber Abl, Fyn, Kit, Lck, Lyn und Yes. Phase 2. | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Ziele |
|
||||||||||
| In vitro | Infigratinib (BGJ398) verhindert auch VEGFR2 mit geringer Potenz, mit einer IC50 von 0,18 μM zur Hemmung dieses Ziels. Es unterdrückt andere Kinasen, einschließlich ABL, FYN, KIT, LCK, LYN und YES mit IC50-Werten von 2,3 μM, 1,9 μM, 0,75 μM, 2,5 μM, 0,3 μM bzw. 1,1 μM. Auf zellulärer Ebene hemmt diese Verbindung die Proliferation der FGFR1-, FGFR2-Q- und FGFR3-abhängigen BaF3-Zellen mit einer IC50 von 2,9 μM, 2,0 μM bzw. 2 μM. Es stört die Autophosphorylierung an spezifischen Tyrosinresten, einschließlich FGFR-WT, FGFR2-WT, FGFR3-K650E, FGFR3-S249C und FGFR4-WT mit einer IC50 von 4,6 nM, 4,9 nM, 5 nM, 5 nM bzw. 168 nM. Zusätzlich unterdrückt es die Proliferation der Krebszellen mit Wildtyp (WT) FGFR3-Überexpression wie RT112, RT4, SW780 und JMSU1 mit einer IC50 von 5 nM, 30 nM, 32 nM bzw. 15 nM. | ||||||||||
| In vivo | In diesem orthotopen Xenograft-Blasenkrebsmodell induziert BGJ398 nach oraler Verabreichung über 12 aufeinanderfolgende Tage in Dosen von 10 bzw. 30 mg/kg eine Tumorwachstumshemmung und Stase. Interessanterweise zeigen die Tiere, die diese Verbindung erhielten, entweder keinen Gewichtsverlust (10 mg/kg) oder eine Gewichtszunahme von 10% (30 mg/kg), ein weiterer Hinweis auf die Wirksamkeit. RT112-Tumor-tragende und weibliche Rowett-Ratten erhalten eine einmalige orale Verabreichung des Monophosphatsalzes von Infigratinib (BGJ398) in Dosen von 4,25 und 8,51 mg/kg. Es reduziert die Spiegel von pFRS2 und pMAPK signifikant dosisabhängig. Zusätzlich hemmt es signifikant die bFGF-stimulierte Angiogenesis dosisabhängig. Es beeinträchtigt jedoch nicht die VEGF-induzierte Blutgefäßbildung. |
Protokoll (aus Referenz)
| Kinase-Assay: [1] |
|
|---|---|
| Zell-Assay:[1] |
|
| Tierstudie:[1] |
|
Referenzen
|
Kundenproduktvalidierung

-
Daten von [ Hepatology , 2014 , 59(4), 1427-34 ]
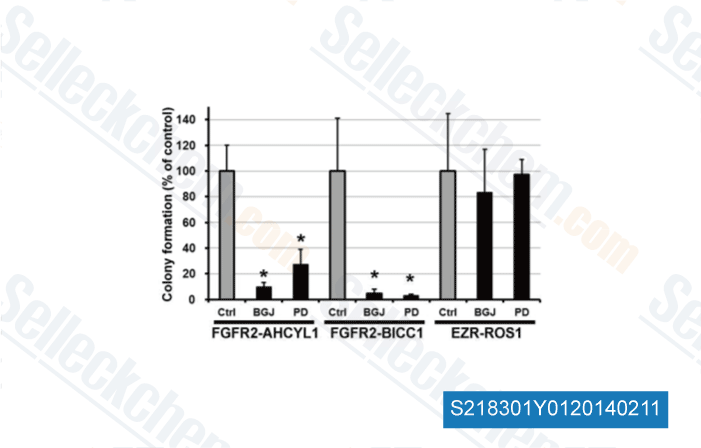
-
Daten von [ Hepatology , 2014 , 59(4), 1427-34 ]

-
Daten von [ J Cell Physiol , 2014 , 229(11), 1647-59 ]

-
, , Oncogene, 2017, 36(27):3831-3841
Sellecks BGJ398 (Infigratinib) Wurde zitiert von 256 Publikationen
| 3D-Printed Scaffolds Promote Enhanced Spinal Organoid Formation for Use in Spinal Cord Injury [ Adv Healthc Mater, 2025, e04817.] | PubMed: 40702833 |
| Selective degradation of FGFR1/2 overcomes antiestrogen resistance in ER+ breast cancer with FGFR1/2 alterations [ Cancer Lett, 2025, 619:217668] | PubMed: 40127812 |
| Abrogation of FGFR signaling blocks β-catenin-induced adrenocortical hyperplasia and aldosterone production [ JCI Insight, 2025, 10(21)e184863] | PubMed: 40956622 |
| Fibroblast growth factor receptor signaling modulates cholesterol storage in a SOAT1-dependent manner to promote mammary tumor cell invasion [ Breast Cancer Res, 2025, 27(1):132] | PubMed: 40665359 |
| Exploiting collateral sensitivity in the evolution of resistance to tyrosine kinase inhibitors in soft tissue sarcomas [ Commun Biol, 2025, 8(1):1185] | PubMed: 40781553 |
| Sonic hedgehog and fibroblast growth factor 8 regulate the evolution of amniote facial proportions [ Commun Biol, 2025, 8(1):84] | PubMed: 39827295 |
| Aspirin-triggered DHA metabolites inhibit angiogenesis [ Front Pharmacol, 2025, 16:1524980] | PubMed: 40070577 |
| Generation of an induced pluripotent stem cell line (NCHi023-A) from a 41-year-old male with nemaline myopathy carrying autosomal dominant ACTA1 c.809-10C>A mutation [ Stem Cell Res, 2025, 85:103701] | PubMed: 40147060 |
| Characterization of an induced pluripotent stem cell line NCHi025-A from a 1-year-old female with pulmonary stenosis harboring a heterozygous HAND2 variant [ Stem Cell Res, 2025, 86:103733] | PubMed: 40378586 |
| Decaying and expanding Erk gradients process memory of skeletal size during zebrafish fin regeneration [ bioRxiv, 2025, 2025.01.23.634576] | PubMed: 39896678 |
RÜCKGABERICHTLINIE
Die bedingungslose Rückgaberichtlinie von Selleck Chemical gewährleistet unseren Kunden ein reibungsloses Online-Einkaufserlebnis. Wenn Sie in irgendeiner Weise mit Ihrem Kauf unzufrieden sind, können Sie jeden Artikel innerhalb von 7 Tagen nach Erhalt zurückgeben. Im Falle von Produktqualitätsproblemen, sei es protokollbezogene oder produktbezogene Probleme, können Sie jeden Artikel innerhalb von 365 Tagen ab dem ursprünglichen Kaufdatum zurückgeben. Bitte befolgen Sie die nachstehenden Anweisungen, wenn Sie Produkte zurücksenden.
VERSAND UND LAGERUNG
Selleck-Produkte werden bei Raumtemperatur transportiert. Wenn Sie das Produkt bei Raumtemperatur erhalten, seien Sie versichert, dass die Qualitätskontrollabteilung von Selleck Experimente durchgeführt hat, um zu überprüfen, dass die normale Temperaturplatzierung von einem Monat die biologische Aktivität von Pulverprodukten nicht beeinträchtigt. Nach dem Sammeln lagern Sie das Produkt bitte gemäß den in der Datenblatt beschriebenen Anforderungen. Die meisten Selleck-Produkte sind unter den empfohlenen Bedingungen stabil.
NICHT FÜR DIE ANWENDUNG AM MENSCHEN, FÜR VETERINÄRMEDIZINISCHE DIAGNOSTIK ODER THERAPEUTISCHE ZWECKE.
