Technische Daten
| Formel | C29H29N7O2 |
||||||||||
| Molekulargewicht | 507.59 | CAS-Nr. | 1410880-22-6 | ||||||||
| Löslichkeit (25°C)* | In vitro | DMSO | 100 mg/mL (197.0 mM) | ||||||||
| Water | Insoluble | ||||||||||
| Ethanol | Insoluble | ||||||||||
| In vivo (Lösungsmittel einzeln und der Reihe nach zum Produkt hinzufügen.) |
|
||||||||||
|
* <1 mg/ml bedeutet schwer löslich oder unlöslich. * Bitte beachten Sie, dass Selleck die Löslichkeit aller Verbindungen intern testet und die tatsächliche Löslichkeit geringfügig von veröffentlichten Werten abweichen kann. Dies ist normal und ist auf geringfügige Batch-zu-Batch-Variationen zurückzuführen. * Versand bei Raumtemperatur (Stabilitätstests zeigen, dass dieses Produkt ohne Kühlmaßnahmen versendet werden kann.) |
|||||||||||
Vorbereitung von Stammlösungen
Biologische Aktivität
| Beschreibung | JNK-IN-8 (JNK Inhibitor XVI) ist der erste irreversible JNK-Inhibitor für JNK1, JNK2 und JNK3 mit einer IC50 von 4,7 nM, 18,7 nM und 1 nM, einer >10-fachen Selektivität gegenüber MNK2, Fms und keiner Hemmung von c-Kit, Met, PDGFRβ in der A375-Zelllinie. | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Ziele |
|
||||||||||
| In vitro | JNK-IN-8 hemmt die c-Jun-Phosphorylierung in HeLa- und A375-Zellen mit einer EC50 von 486 nM bzw. 338 nM. Diese Verbindung zeigt eine dramatische Verbesserung der Selektivität und eliminierte die Bindung an IRAK1, PIK3C3, PIP4K2C und PIP5K3. Es erfordert Cys116 für die JNK2-Hemmung. Diese Chemikalie (10 mM) unterdrückt die IL-1β-stimulierte Phosphorylierung von c-Jun in IL-1R-Zellen, einem etablierten Substrat der JNKs. Die kovalente Anlagerung an die JNK-Isoformen führte zu einer geringen Verzögerung der elektrophoretischen Mobilität der JNK-Isoformen. Es wurde entdeckt, dass es die JNK-Kinase durch ein breit angelegtes Kinase-Selektivitätsprofiling einer Bibliothek von Acrylamid-Kinase-Inhibitoren basierend auf der Struktur unter Verwendung des KinomeScan-Ansatzes hemmt. Diese Verbindung besitzt eine ausgeprägte Regiochemie der 1,4-Dianilin- und 1,3-Aminobenzoesäure-Untereinheiten. Es nimmt eine L-förmige Typ-I-Bindungskonformation an, um Cys 154 zu erreichen, das sich zum Rand der ATP-Bindungsstelle hin befindet. |
||||||||||
| In vivo | JNK-IN-8 ist ein potenter JNK-Inhibitor, der speziell die JNK-Aktivierung hemmt. Er besitzt antifungale Aktivität. |
||||||||||
| Merkmale | JNK-IN-8 und JNK-IN-7 sind strukturell sehr ähnlich, doch während ersteres ein spezifischer kovalenter Inhibitor von JNKs ist. |
Protokoll (aus Referenz)
| Kinase-Assay: |
|
|---|---|
| Tierstudie: |
|
Referenzen
|
Kundenproduktvalidierung
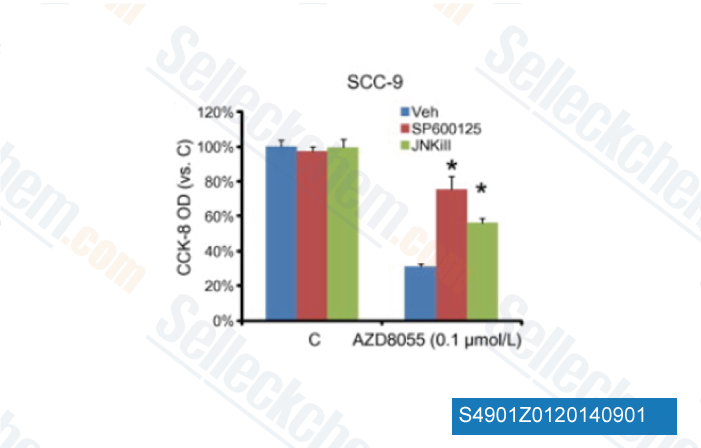
-
Daten von [ Biochem Biophys Res Commun , 2013 , 440(4), 701-6 ]
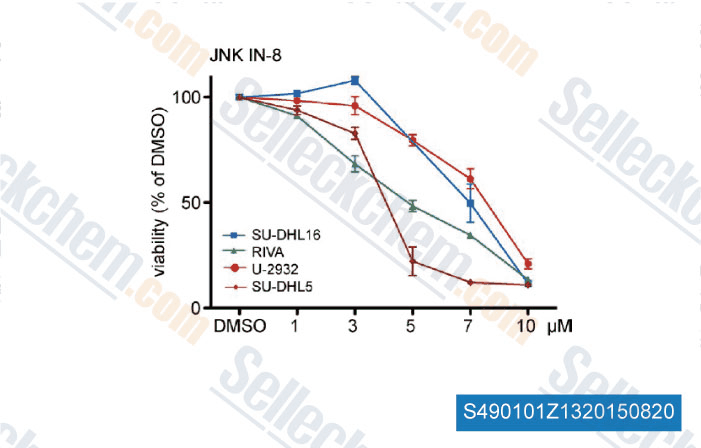
-
Daten von [ , , J Exp Med, 2015, 212(5): 775-92 ]
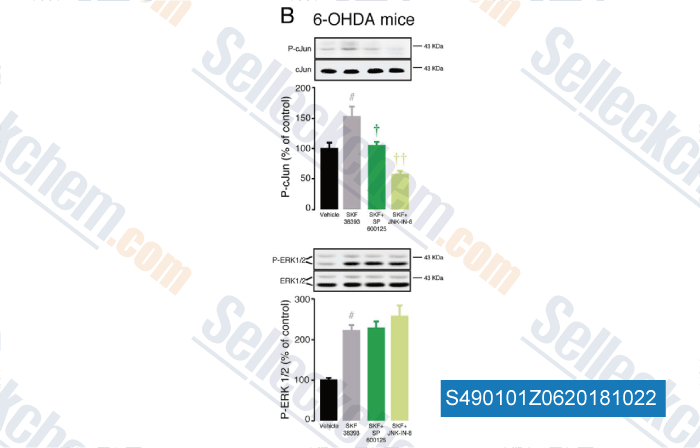
-
Daten von [ , , Neurobiol Dis, 2018, 110:37-46 ]
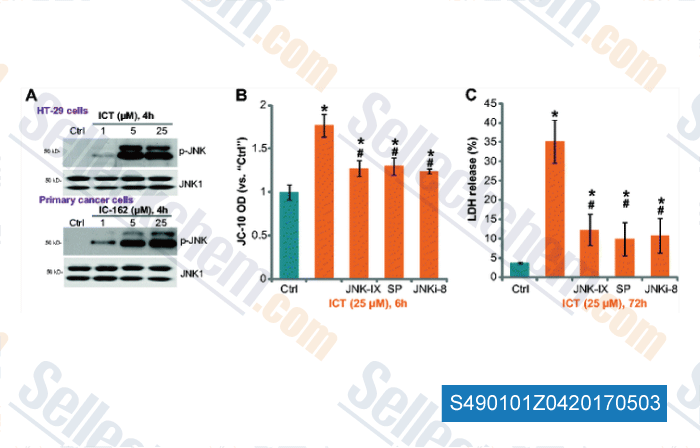
-
Daten von [ , , Tumour Biol, 2016, 37(3):3135-44 ]
Sellecks JNK-IN-8 Wurde zitiert von 102 Publikationen
| Macropinocytosis maintains CAF subtype identity under metabolic stress in pancreatic cancer [ Cancer Cell, 2025, S1535-6108(25)00271-5] | PubMed: 40712568 |
| Oncogenic RAS induces a distinctive form of non-canonical autophagy mediated by the P38-ULK1-PI4KB axis [ Cell Res, 2025, 10.1038/s41422-025-01085-9] | PubMed: 40055523 |
| Spike-in enhanced phosphoproteomics uncovers synergistic signaling responses to MEK inhibition in colon cancer cells [ Nat Commun, 2025, 16(1):4884] | PubMed: 40419504 |
| SLFN11-mediated ribosome biogenesis impairment induces TP53-independent apoptosis [ Mol Cell, 2025, S1097-2765(25)00042-5] | PubMed: 39909041 |
| Inhibiting JNK and PI3K-Akt signaling pathways altered spontaneous network bursts and developmental trajectories of neuronal networks [ J Neural Eng, 2025, 22(5)] | PubMed: 40897198 |
| L1CAM signaling through planar cell polarity generates SOX2 + metastatic progenitors in lung adenocarcinoma [ bioRxiv, 2025, 2025.08.22.671773] | PubMed: 40894609 |
| [C6TSEDRVAJZ, a combination of small-molecule compounds, induces differentiation of human placental fibroblasts into epithelioid cells in vitro] [ Nan Fang Yi Ke Da Xue Xue Bao, 2025, 45(2):322-330] | PubMed: 40031976 |
| The ribotoxic stress response drives UV-mediated cell death [ Cell, 2024, 187(14):3652-3670.e40] | PubMed: 38843833 |
| Pharmacogenomic profiling of intra-tumor heterogeneity using a large organoid biobank of liver cancer [ Cancer Cell, 2024, 42(4):535-551.e8] | PubMed: 38593780 |
| Reversible covalent c-Jun N-terminal kinase inhibitors targeting a specific cysteine by precision-guided Michael-acceptor warheads [ Nat Commun, 2024, 15(1):8606] | PubMed: 39366946 |
RÜCKGABERICHTLINIE
Die bedingungslose Rückgaberichtlinie von Selleck Chemical gewährleistet unseren Kunden ein reibungsloses Online-Einkaufserlebnis. Wenn Sie in irgendeiner Weise mit Ihrem Kauf unzufrieden sind, können Sie jeden Artikel innerhalb von 7 Tagen nach Erhalt zurückgeben. Im Falle von Produktqualitätsproblemen, sei es protokollbezogene oder produktbezogene Probleme, können Sie jeden Artikel innerhalb von 365 Tagen ab dem ursprünglichen Kaufdatum zurückgeben. Bitte befolgen Sie die nachstehenden Anweisungen, wenn Sie Produkte zurücksenden.
VERSAND UND LAGERUNG
Selleck-Produkte werden bei Raumtemperatur transportiert. Wenn Sie das Produkt bei Raumtemperatur erhalten, seien Sie versichert, dass die Qualitätskontrollabteilung von Selleck Experimente durchgeführt hat, um zu überprüfen, dass die normale Temperaturplatzierung von einem Monat die biologische Aktivität von Pulverprodukten nicht beeinträchtigt. Nach dem Sammeln lagern Sie das Produkt bitte gemäß den in der Datenblatt beschriebenen Anforderungen. Die meisten Selleck-Produkte sind unter den empfohlenen Bedingungen stabil.
NICHT FÜR DIE ANWENDUNG AM MENSCHEN, FÜR VETERINÄRMEDIZINISCHE DIAGNOSTIK ODER THERAPEUTISCHE ZWECKE.
