Technische Daten
| Formel | C26H33FN4O3S |
||||||
| Molekulargewicht | 500.63 | CAS-Nr. | 1005342-46-0 | ||||
| Löslichkeit (25°C)* | In vitro | DMSO | 100 mg/mL (199.74 mM) | ||||
| Ethanol | 100 mg/mL (199.74 mM) | ||||||
| Water | Insoluble | ||||||
| In vivo (Lösungsmittel einzeln und der Reihe nach zum Produkt hinzufügen.) |
|
||||||
|
* <1 mg/ml bedeutet schwer löslich oder unlöslich. * Bitte beachten Sie, dass Selleck die Löslichkeit aller Verbindungen intern testet und die tatsächliche Löslichkeit geringfügig von veröffentlichten Werten abweichen kann. Dies ist normal und ist auf geringfügige Batch-zu-Batch-Variationen zurückzuführen. * Versand bei Raumtemperatur (Stabilitätstests zeigen, dass dieses Produkt ohne Kühlmaßnahmen versendet werden kann.) |
|||||||
Vorbereitung von Stammlösungen
Biologische Aktivität
| Beschreibung | LCL-161, ein niedermolekulares second mitochondrial activator of caspase (SMAC)-Mimetikum, bindet potent an mehrere IAPs (d.h. XIAP, c-IAP) und hemmt diese. | ||
|---|---|---|---|
| Ziele |
|
||
| In vitro | LCL161 bindet mit hoher Affinität an Inhibitoren von Apoptoseproteinen (IAPs) und initiiert die Zerstörung von cIAP1 und cIAP2, was ferner die Apoptose über die Caspase-Aktivierung induziert. Diese Verbindung hemmt das Wachstum von FLT3-ITD-exprimierenden Zellen bei alleiniger Verabreichung bescheiden, mit einer IC50 im Bereich von ~0,5 μM (Ba/F3-FLT3-ITD-Zellen) bis ~4 μM (MOLM13-luc+-Zellen). Die Wirksamkeit dieses Wirkstoffs gegen die D835Y-Mutante wird als erheblich höher beobachtet, mit einer IC50 von ~50 nM, wenn er gegen Ba/F3-D835Y-Zellen getestet wird. Die Behandlung von MOLM13-luc+-Zellen mit einer Kombination dieser Verbindung und PKC412 führt zu einer signifikant stärkeren Abtötung von Zellen als jeder Wirkstoff allein, wobei die Calcusyn-Kombinationsindizes Synergie nahelegen. PKC412 und diese Chemikalie induzieren Apoptose von MOLM13-luc+-Zellen. Die Kombination von PKC412 und diesem Wirkstoff führt zu einer höheren Induktion der Apoptose als jeder Wirkstoff allein. Es ist in der Lage, die Stroma-vermittelte Rettung von mutant FLT3-exprimierenden Zellen durch positive Kombination mit PKC412 zu überwinden. Diese Verbindung hemmt das Wachstum von Ba/F3.p210-Zellen mit einer IC50 von ~100 nM. Es hat auch eine Aktivität gegen medikamentenresistente Zellen gezeigt, die Punktmutationen in den Zielproteinen exprimieren. Dieser Wirkstoff bei 1000 nM ist in der Lage, Ba/F3-abgeleitete Zelllinien, die Resistenz gegen PKC412 verleihen und FLT3-ITD mit Punktmutationen in der ATP-Bindetasche von FLT3 exprimieren, größtenteils oder vollständig abzutöten. Es zeigt auch Aktivität in Konzentrationen von 100 bis 1000 nM gegen Ba/F3-Zellen, die verschiedene exprimieren. Diese Verbindung wird gegen die 23 Zelllinien im Pediatric Preclinical Testing Program (PPTP) in vitro-Panel über 96 Stunden evaluiert. Sie erreicht eine 50%ige Wachstumshemmung bei nur 3 der 23 getesteten PPTP-Zelllinien bei einer Konzentration von 10 μM. Die drei Zelllinien umfassen zwei T-Zell-ALL-Zelllinien (COG-LL-317 und CCRF-CEM) und eine anaplastische großzellige Lymphomzelllinie (Karpas-299), wobei CCRF-CEM und Karpas-299 die niedrigsten relativen IC50-Werte (0,25 bzw. 1,6 μM) zeigen. Es zeigt immunmodulatorische Eigenschaften auf menschliche Immunsubpopulationen. T-Lymphozyten, die mit dieser Verbindung behandelt wurden, zeigen eine signifikant erhöhte Zytokinsekretion bei Aktivierung, mit geringem Einfluss auf das Überleben oder die Proliferation von CD4- und CD8-T-Zellen. Die Behandlung von peripheren Blutmononuklearzellen mit diesem Wirkstoff verbessert signifikant das Priming naiver T-Zellen mit synthetischen Peptiden in vitro. Myeloide dendritische Zellen erfahren eine phänotypische Reifung nach dieser Chemikalie und zeigen eine reduzierte Fähigkeit, einen Tumorantigen-basierten Impfstoff zu kreuzpräsentieren. Diese Effekte werden potenziell durch eine beobachtete Aktivierung der kanonischen und nicht-kanonischen NF-κB-Signalwege nach dieser Verbindung mit einer daraus resultierenden Hochregulierung anti-apoptotischer Moleküle vermittelt. |
||
| In vivo | LCL161 verstärkt signifikant die Fähigkeit von PKC412, das Wachstum von Ba/F3-FLT3-ITD-luc+-Zellen in vivo zu hemmen. Diese Verbindung zeigt auch eine positive Kombination mit den Standard-Chemotherapeutika Ara-c und Doxorubicin gegen FLT3-ITD-exprimierende Zellen und gegen D835Y-exprimierende Zellen. Es wird ein additiver Effekt erzielt, indem beide Chemikalien bei der Unterdrückung des Leukämiewachstums kombiniert werden. Dieser Wirkstoff (100 mg/kg) verstärkt die In-vivo-Wirkungen von hohen bis moderaten Dosen auf die Leukämielast bei Mäusen. Diese Verbindung wird gegen die Pediatric Preclinical Testing Program (PPTP) in vivo-Panels (30 oder 75 mg/kg [solide Tumoren] oder 100 mg/kg [ALL]) zweimal wöchentlich oral verabreicht getestet. Es induziert signifikante Unterschiede in der EFS-Verteilung bei etwa einem Drittel der soliden Tumor-Xenografts (Osteosarkom und Glioblastom), jedoch nicht bei ALL-Xenografts. Es werden keine objektiven Tumorantworten beobachtet. In vivo zeigt diese Chemikalie eine begrenzte Einzelwirkstoffaktivität gegen die untersuchten pädiatrischen präklinischen Modelle. |
Protokoll (aus Referenz)
| Zell-Assay: |
|
|---|---|
| Tierstudie: |
|
Referenzen
|
Kundenproduktvalidierung
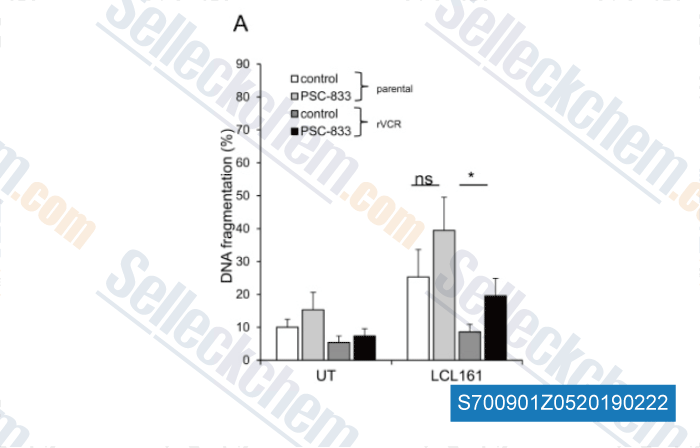
-
Daten von [ , , Cancer Lett, 2018, 440-441:126-134 ]
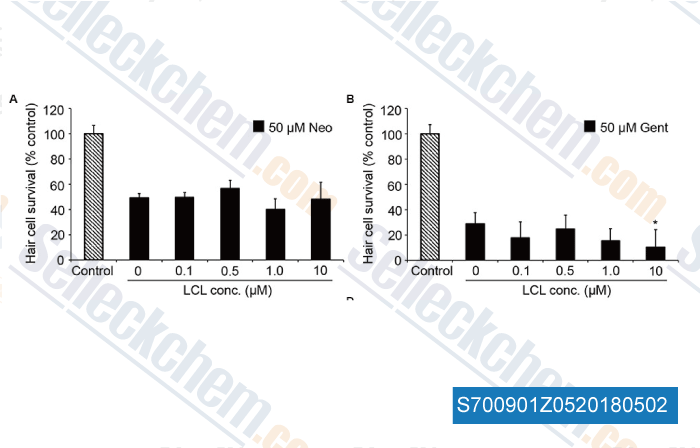
-
Daten von [ , , Front Cell Neurosci, 2017, https://doi.org/10.3389/fncel.2017.00326 ]
Sellecks LCL161 Wurde zitiert von 48 Publikationen
| Single-cell transcriptomic and functional studies identify glial state changes and a role for inflammatory RIPK1 signaling in ALS pathogenesis [ Immunity, 2025, 58(4):961-979.e8] | PubMed: 40132594 |
| Ferroptosis-activating metabolite acrolein antagonizes necroptosis and anti-cancer therapeutics [ Nat Commun, 2025, 16(1):4919] | PubMed: 40425585 |
| Targeting cIAP2 in a novel senolytic strategy prevents glioblastoma recurrence after radiotherapy [ EMBO Mol Med, 2025, 10.1038/s44321-025-00201-x] | PubMed: 39972068 |
| Astrocytes and the tumor microenvironment inflammatory state dictate the killing of glioblastoma cells by Smac mimetic compounds [ Cell Death Dis, 2024, 15(8):592] | PubMed: 39147758 |
| Combination of bazedoxifene with chemotherapy and SMAC-mimetics for the treatment of colorectal cancer [ Cell Death Dis, 2024, 15(4):255] | PubMed: 38600086 |
| Complex IIa formation and ABC transporters determine sensitivity of OSCC to Smac mimetics [ Cell Death Dis, 2024, 15(11):855] | PubMed: 39578442 |
| SPOP-mediated RIPK3 destabilization desensitizes LPS/sMAC/zVAD-induced necroptotic cell death [ Cell Mol Life Sci, 2024, 81(1):451] | PubMed: 39540935 |
| A comparative study of apoptosis, pyroptosis, necroptosis, and PANoptosis components in mouse and human cells [ PLoS One, 2024, 19(2):e0299577] | PubMed: 38412164 |
| Single-molecule fingerprinting of protein-drug interaction using a funneled biological nanopore [ Nat Commun, 2023, 14(1):1461] | PubMed: 37015934 |
| Dimethyl fumarate inhibits necroptosis and alleviates systemic inflammatory response syndrome by blocking the RIPK1-RIPK3-MLKL axis [ Pharmacol Res, 2023, 189:106697] | PubMed: 36796462 |
RÜCKGABERICHTLINIE
Die bedingungslose Rückgaberichtlinie von Selleck Chemical gewährleistet unseren Kunden ein reibungsloses Online-Einkaufserlebnis. Wenn Sie in irgendeiner Weise mit Ihrem Kauf unzufrieden sind, können Sie jeden Artikel innerhalb von 7 Tagen nach Erhalt zurückgeben. Im Falle von Produktqualitätsproblemen, sei es protokollbezogene oder produktbezogene Probleme, können Sie jeden Artikel innerhalb von 365 Tagen ab dem ursprünglichen Kaufdatum zurückgeben. Bitte befolgen Sie die nachstehenden Anweisungen, wenn Sie Produkte zurücksenden.
VERSAND UND LAGERUNG
Selleck-Produkte werden bei Raumtemperatur transportiert. Wenn Sie das Produkt bei Raumtemperatur erhalten, seien Sie versichert, dass die Qualitätskontrollabteilung von Selleck Experimente durchgeführt hat, um zu überprüfen, dass die normale Temperaturplatzierung von einem Monat die biologische Aktivität von Pulverprodukten nicht beeinträchtigt. Nach dem Sammeln lagern Sie das Produkt bitte gemäß den in der Datenblatt beschriebenen Anforderungen. Die meisten Selleck-Produkte sind unter den empfohlenen Bedingungen stabil.
NICHT FÜR DIE ANWENDUNG AM MENSCHEN, FÜR VETERINÄRMEDIZINISCHE DIAGNOSTIK ODER THERAPEUTISCHE ZWECKE.
