Technische Daten
| Formel | C22H21ClFN3O3S |
||||||||||
| Molekulargewicht | 461.94 | CAS-Nr. | 1010085-13-8 | ||||||||
| Löslichkeit (25°C)* | In vitro | DMSO | 92 mg/mL (199.16 mM) | ||||||||
| Water | Insoluble | ||||||||||
| Ethanol | Insoluble | ||||||||||
| In vivo (Lösungsmittel einzeln und der Reihe nach zum Produkt hinzufügen.) |
|
||||||||||
|
* <1 mg/ml bedeutet schwer löslich oder unlöslich. * Bitte beachten Sie, dass Selleck die Löslichkeit aller Verbindungen intern testet und die tatsächliche Löslichkeit geringfügig von veröffentlichten Werten abweichen kann. Dies ist normal und ist auf geringfügige Batch-zu-Batch-Variationen zurückzuführen. * Versand bei Raumtemperatur (Stabilitätstests zeigen, dass dieses Produkt ohne Kühlmaßnahmen versendet werden kann.) |
|||||||||||
Vorbereitung von Stammlösungen
Biologische Aktivität
| Beschreibung | MK-5108 (VX-689) ist ein hochselektiver Aurora A-Inhibitor mit einer IC50 von 0,064 nM in einem zellfreien Assay und ist 220- und 190-fach selektiver für Aurora A als für Aurora B/C, während er TrkA mit weniger als 100-facher Selektivität hemmt. Diese Verbindung induziert Autophagy. Phase 1. | ||
|---|---|---|---|
| Ziele |
|
||
| In vitro | MK-5108 hemmt die Aurora-A-Aktivität auf ATP-kompetitive Weise. Diese Verbindung zeigt in biochemischen Assays eine robuste Selektivität gegenüber den anderen Familienkinasen Aurora-B (220-fach) und Aurora-C (190-fach). Es zeigt auch eine hohe Selektivität für Aurora-A gegenüber anderen Proteinkinasen. Die Verbindung hemmt nur eine Kinase (TrkA) mit einer Selektivität von <100-fach. Es könnte selektiver für Aurora-A sein als MLN8054. Im Einklang mit der Induktion von pHH3-positiven Zellen induziert diese Chemikalie die Akkumulation von Zellen in der G2-M-Phase. Es hemmt die Proliferation von Tumorzellen, einschließlich HCC1143, AU565, MCF-7, HCC1806 und CAL85-1, mit einer IC50 von 0,42 μM, 0,45 μM, 0,52 μM, 0,56 μM bzw. 0,74 μM. Diese Verbindung verringert die Zellviabilität dosisabhängig in allen drei Zelllinien, einschließlich LEIO285-, LEIO505- und SK-LSM1-Zellen, mit einer IC50 von ungefähr 100 nM. Die Inkubation damit in LEIO285 erhöht den Anteil der Zellen in G2/M 48 und 72 Stunden nach der Behandlung. Die Verbindung erhöht die Caspase-3/7-Aktivität im Vergleich zu DMSO-behandelten Kontrollkulturen zu beiden Zeitpunkten signifikant. In LEIO505-Zellen führt sie zu einer stärkeren Akkumulation von Zellen in den G2/M-Phasen nach 24 Stunden, aber nicht nach 48 oder 72 Stunden. |
||
| In vivo | MK-5108 induziert pHH3-positive Zellen in Dosen von 16 mg/kg und 32 mg/kg. Die Plasmakonzentration dieser Verbindung bei 8 mg/kg und 16 mg/kg beträgt 1,7 μM bzw. 4,4 μM. Diese Verbindung führt zur Induktion von pHH3 in Tumor- und Hautgeweben, die nach 2 Stunden beginnt und nach 4 Stunden ein Maximum erreicht. Chemische Behandlungen mit 15 mg/kg und 30 mg/kg führen zu einer signifikanten Hemmung des Tumorwachstums mit einer Änderung des mittleren Tumorvolumens für die Behandlungsgruppe als Prozentsatz der mittleren Änderung in der Kontrollgruppe (%T/C) von 10 % und −6 % an Tag 11 bzw. 17 % und 5 % an Tag 18. Es wird bei beiden Dosen gut vertragen, mit minimaler Reduzierung des Körpergewichts. Diese Verbindung zeigt auch eine signifikante Antitumoraktivität durch intermittierende Dosierung bei nackten Ratten mit SW48-Tumoren, wobei 15 mg/kg und 45 mg/kg eine dosisabhängige Tumorwachstumshemmung mit einem %T/C von 35 % und 7 % an Tag 10 bzw. 58 % und 32 % an Tag 27 verursachen. |
Protokoll (aus Referenz)
| Kinase-Assay: |
|
|---|---|
| Zell-Assay: |
|
| Tierstudie: |
|
Referenzen
|
Kundenproduktvalidierung
-S277001W0220130927.gif)
-
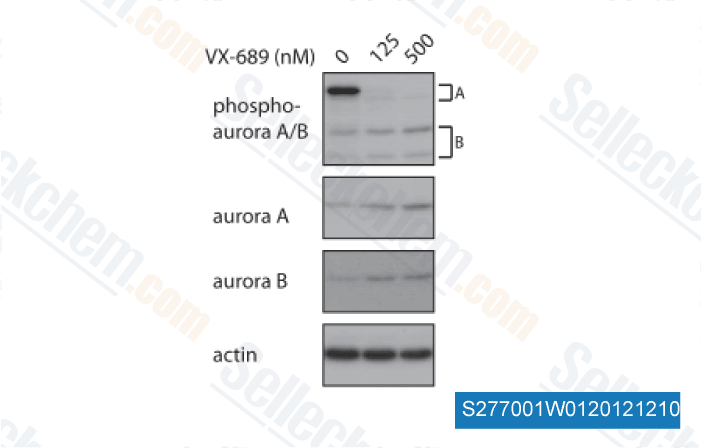
Daten von [ Oncogene , 2014 , 33, 3550-60 ]

-
Daten von [ Cancer Discov , 2013 , 10.1158/2159-8290.CD-12-0426 ]
![P53 expression in the 14G2a mAb-treated IMR-32 cell line and after combinatorial treatment with MK-5108 inhibitor. P53 protein content was measured in whole cell-WCE (A), cytoplasmic-CE (C) and nuclear-NE (E) extracts at 2, 6, 24 and 48 h after 14G2a addition (40 ug/ml) into culture media of IMR-32 cells, and normalized to GAPDH levels (for WCE and CE), or TBP (for NE). Mean values of three separate experiments (盨EM) obtained for the 14G2a mAb-treated cells are shown as empty bars, and calculated versus control value, set as 1 (black baseline). ANOVA shows no statistically significant changes of P53 level in time in IMR-32 WCE [F(3, 9) = 1.35, p = 0.3181]. Statistically significant changes of P53 level in time were found in CE [F(3, 6) = 53.76, p = 0.0001], and in NE [F(3, 6) = 63.17, p = 0.0001], as compared to 2 h time point. P53 expression level was measured in whole cell-WCE (B), cytoplasmic-CE (D) and nuclear-NE (F) extracts at 2 and 24 h after the 14G2a mAb treatment alone (white bars with black stripes) or in combination with MK-5108 inhibitor (black bars with white stripes), and normalized to GAPDH levels (for WCE and CE), or TBP (for NE). Below each chart representative immunoblottings are presented; C-control cells; mAb-the 14G2a mAb-treated cells; I + mAb-MK-5108 inhibitor and the mAb-treated cells. P-values for t-test were as follow: p < 0.05 (*), p < 0.01 (**), p < 0.001 (***).](https://file.selleckchem.com/downloads/review/700px/VX-689-S2770W0220150108.gif)
-
Daten von [ Cancer Lett , 2013 , 341(2), 248-64 ]
-
, , Ken Ma Hong Kong University of Science & Technology
Sellecks MK-5108 Wurde zitiert von 41 Publikationen
| Establishment, characterization, and biobanking of 36 pancreatic cancer organoids: prediction of metastasis in resectable pancreatic cancer [ Cell Oncol (Dordr), 2024, 10.1007/s13402-024-00939-5] | PubMed: 38619751 |
| Inhibition of epigenetic and cell cycle-related targets in glioblastoma cell lines reveals that onametostat reduces proliferation and viability in both normoxic and hypoxic conditions [ Sci Rep, 2024, 14(1):4303] | PubMed: 38383756 |
| Exploiting ulnerabilities induced b recurrent mutations in chondrosarcoma and giant cell tumour of bone: therapeutic targeting of the altered epigenome and be [ Leiden University The Netherlands, 2023, ] | PubMed: None |
| Spatially distinct inputs modulate the amount of active Mitotic-phase GAP to locally restrict RhoA signaling for successful cell division [ bioRxiv, 2023, 10.1101/2023.08.08.552464] | PubMed: None |
| Revisiting the Resazurin-Based Sensing of Cellular Viability: Widening the Application Horizon [ Biosensors (Basel), 2022, 12(4)196] | PubMed: 35448256 |
| Culture and multiomic analysis of lung cancer patient-derived pleural effusions revealed distinct druggable molecular types [ Sci Rep, 2022, 12(1):6345] | PubMed: 35428753 |
| 選択的オーロラキナーゼ A 阻害剤 TAS-119 を用いたオーロラキナーゼ A 阻害剤の薬剤感受性マーカーの探索 [ , 2022, ] | PubMed: none |
| Targeting Aurora B kinase prevents and overcomes resistance to EGFR inhibitors in lung cancer by enhancing BIM- and PUMA-mediated apoptosis [ Cancer Cell, 2021, S1535-6108(21)00383-4] | PubMed: 34388376 |
| Multifocal Organoid Capturing of Colon Cancer Reveals Pervasive Intratumoral Heterogenous Drug Responses [ Adv Sci (Weinh), 2021, e2103360] | PubMed: 34918496 |
| Size-Selective VAILase Proteolysis Provides Dynamic Insights into Protein Structures [ Anal Chem, 2021, 93(30):10653-10660] | PubMed: 34291915 |
RÜCKGABERICHTLINIE
Die bedingungslose Rückgaberichtlinie von Selleck Chemical gewährleistet unseren Kunden ein reibungsloses Online-Einkaufserlebnis. Wenn Sie in irgendeiner Weise mit Ihrem Kauf unzufrieden sind, können Sie jeden Artikel innerhalb von 7 Tagen nach Erhalt zurückgeben. Im Falle von Produktqualitätsproblemen, sei es protokollbezogene oder produktbezogene Probleme, können Sie jeden Artikel innerhalb von 365 Tagen ab dem ursprünglichen Kaufdatum zurückgeben. Bitte befolgen Sie die nachstehenden Anweisungen, wenn Sie Produkte zurücksenden.
VERSAND UND LAGERUNG
Selleck-Produkte werden bei Raumtemperatur transportiert. Wenn Sie das Produkt bei Raumtemperatur erhalten, seien Sie versichert, dass die Qualitätskontrollabteilung von Selleck Experimente durchgeführt hat, um zu überprüfen, dass die normale Temperaturplatzierung von einem Monat die biologische Aktivität von Pulverprodukten nicht beeinträchtigt. Nach dem Sammeln lagern Sie das Produkt bitte gemäß den in der Datenblatt beschriebenen Anforderungen. Die meisten Selleck-Produkte sind unter den empfohlenen Bedingungen stabil.
NICHT FÜR DIE ANWENDUNG AM MENSCHEN, FÜR VETERINÄRMEDIZINISCHE DIAGNOSTIK ODER THERAPEUTISCHE ZWECKE.
