Technische Daten
| Formel | C13H13N3OS |
||||||
| Molekulargewicht | 259.33 | CAS-Nr. | 4311-88-0 | ||||
| Löslichkeit (25°C)* | In vitro | DMSO | 52 mg/mL (200.51 mM) | ||||
| Water | Insoluble | ||||||
| Ethanol | Insoluble | ||||||
| In vivo (Lösungsmittel einzeln und der Reihe nach zum Produkt hinzufügen.) |
|
||||||
|
* <1 mg/ml bedeutet schwer löslich oder unlöslich. * Bitte beachten Sie, dass Selleck die Löslichkeit aller Verbindungen intern testet und die tatsächliche Löslichkeit geringfügig von veröffentlichten Werten abweichen kann. Dies ist normal und ist auf geringfügige Batch-zu-Batch-Variationen zurückzuführen. * Versand bei Raumtemperatur (Stabilitätstests zeigen, dass dieses Produkt ohne Kühlmaßnahmen versendet werden kann.) |
|||||||
Vorbereitung von Stammlösungen
Biologische Aktivität
| Beschreibung | Necrostatin-1 (Nec-1) ist ein spezifischer RIP1 (RIPK1)-Inhibitor und hemmt die TNF-α-induzierte Nekroptose mit einem EC50 von 490 nM in 293T-Zellen. Necrostatin-1 blockiert auch IDO und unterdrückt Autophagy und Apoptosis. | ||||
|---|---|---|---|---|---|
| Ziele |
|
||||
| In vitro | Necrostatin-1 (1-100 μM) hemmt die Autophosphorylierung von überexprimiertem und endogenem RIP1. Es wurde festgestellt, dass RIP1 das primäre zelluläre Ziel ist, das für die antinecroptotische Aktivität dieser Verbindung verantwortlich ist. Diese Chemikalie unterdrückt effizient den nekroptotischen Zelltod, der durch eine Reihe von Stimuli in einer Vielzahl von Zelltypen ausgelöst wird. Sie, zuvor als niedermolekularer Inhibitor der Nekroptose identifiziert, hemmt die RIP kinase-induzierte Nekroptose und hemmt die TNF-α-induzierte Nekroptose in Jurkat-Zellen mit einem EC50 von 490 nM. |
||||
| In vivo | Necrostatin-1 (Nec-1) ist ein spezifischer niedermolekularer Inhibitor der Rezeptor-interagierenden Proteinkinase 1 (RIPK1), der die Phosphorylierung dieser Verbindung spezifisch hemmt. |
||||
| Merkmale | Ein leistungsstarkes Werkzeug zur Charakterisierung der Rolle der Nekroptose mit einem charakterisierten primären Ziel. |
Protokoll (aus Referenz)
| Kinase-Assay: |
|
|---|---|
| Zell-Assay: |
|
| Tierstudie: |
|
Referenzen
|
Kundenproduktvalidierung
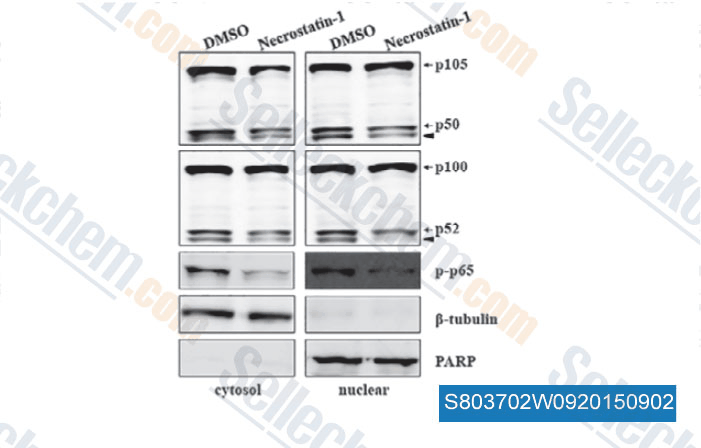
-
Daten von [ , , J Cell Mol Med, 2015, 19(5): 1042-54 ]
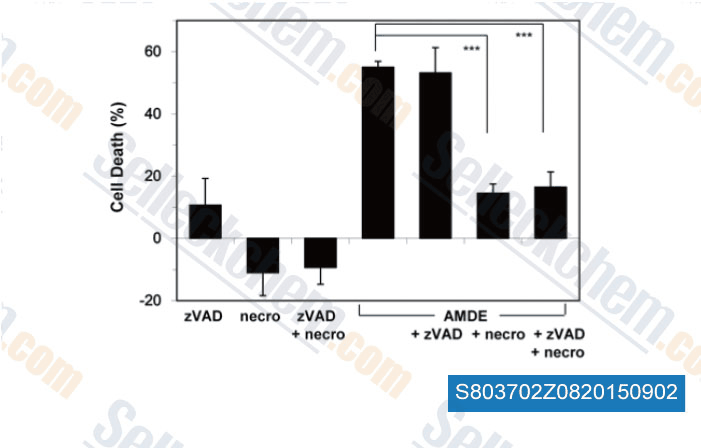
-
Daten von [ , , PLoS One, 2015, 10(3): e0122083 ]
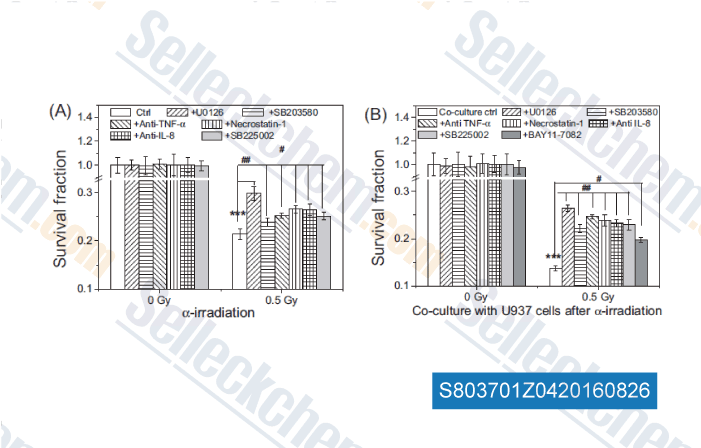
-
Daten von [ , , Mutation Research, 2016, 789:1-8. ]
Sellecks Necrostatin-1 (Nec-1) Wurde zitiert von 321 Publikationen
| Soluble tissue factor generated by necroptosis-triggered shedding is responsible for thrombosis [ Cell Res, 2025, 10.1038/s41422-025-01167-8] | PubMed: 40940518 |
| The noncanonical function of liver-type phosphofructokinase potentiates the efficacy of HDAC inhibitors in cancer [ Signal Transduct Target Ther, 2025, 10(1):341] | PubMed: 41083431 |
| LINE-1 ORF1p Mimics Viral Innate Immune Evasion Mechanisms in Pancreatic Ductal Adenocarcinoma [ Cancer Discov, 2025, 10.1158/2159-8290.CD-24-1317] | PubMed: 39919290 |
| Ferroptosis-activating metabolite acrolein antagonizes necroptosis and anti-cancer therapeutics [ Nat Commun, 2025, 16(1):4919] | PubMed: 40425585 |
| Harnessing the FGFR2/NF2/YAP signaling-dependent necroptosis to develop an FGFR2/IL-8 dual blockade therapeutic strategy [ Nat Commun, 2025, 16(1):4128] | PubMed: 40319089 |
| Targeting pancreatic cancer glutamine dependency confers vulnerability to GPX4-dependent ferroptosis [ Cell Rep Med, 2025, 6(2):101928] | PubMed: 39879992 |
| GCLC desuccinylation regulated by oxidative stress protects human cancer cells from ferroptosis [ Cell Death Differ, 2025, 32(9):1679-1690] | PubMed: 40188196 |
| Carbon ion combined photon radiotherapy induces ferroptosis via NCOA4-mediated ferritinophagy in glioblastoma [ Redox Biol, 2025, 86:103865] | PubMed: 40925125 |
| SLC25A1 and ACLY maintain cytosolic acetyl-CoA and regulate ferroptosis susceptibility via FSP1 acetylation [ EMBO J, 2025, 10.1038/s44318-025-00369-5] | PubMed: 39881208 |
| Akt isoform specificity drives intrinsic immune regulation during HSV-1 infection [ Proc Natl Acad Sci U S A, 2025, 122(27):e2504962122] | PubMed: 40601626 |
RÜCKGABERICHTLINIE
Die bedingungslose Rückgaberichtlinie von Selleck Chemical gewährleistet unseren Kunden ein reibungsloses Online-Einkaufserlebnis. Wenn Sie in irgendeiner Weise mit Ihrem Kauf unzufrieden sind, können Sie jeden Artikel innerhalb von 7 Tagen nach Erhalt zurückgeben. Im Falle von Produktqualitätsproblemen, sei es protokollbezogene oder produktbezogene Probleme, können Sie jeden Artikel innerhalb von 365 Tagen ab dem ursprünglichen Kaufdatum zurückgeben. Bitte befolgen Sie die nachstehenden Anweisungen, wenn Sie Produkte zurücksenden.
VERSAND UND LAGERUNG
Selleck-Produkte werden bei Raumtemperatur transportiert. Wenn Sie das Produkt bei Raumtemperatur erhalten, seien Sie versichert, dass die Qualitätskontrollabteilung von Selleck Experimente durchgeführt hat, um zu überprüfen, dass die normale Temperaturplatzierung von einem Monat die biologische Aktivität von Pulverprodukten nicht beeinträchtigt. Nach dem Sammeln lagern Sie das Produkt bitte gemäß den in der Datenblatt beschriebenen Anforderungen. Die meisten Selleck-Produkte sind unter den empfohlenen Bedingungen stabil.
NICHT FÜR DIE ANWENDUNG AM MENSCHEN, FÜR VETERINÄRMEDIZINISCHE DIAGNOSTIK ODER THERAPEUTISCHE ZWECKE.
