Technische Daten
| Formel | C13H14ClN3O4 |
||||||
| Molekulargewicht | 311.72 | CAS-Nr. | 501925-31-1 | ||||
| Löslichkeit (25°C)* | In vitro | DMSO | 62 mg/mL (198.89 mM) | ||||
| Ethanol | 1 mg/mL (3.2 mM) | ||||||
| Water | Insoluble | ||||||
| In vivo (Lösungsmittel einzeln und der Reihe nach zum Produkt hinzufügen.) |
|
||||||
|
* <1 mg/ml bedeutet schwer löslich oder unlöslich. * Bitte beachten Sie, dass Selleck die Löslichkeit aller Verbindungen intern testet und die tatsächliche Löslichkeit geringfügig von veröffentlichten Werten abweichen kann. Dies ist normal und ist auf geringfügige Batch-zu-Batch-Variationen zurückzuführen. * Versand bei Raumtemperatur (Stabilitätstests zeigen, dass dieses Produkt ohne Kühlmaßnahmen versendet werden kann.) |
|||||||
Vorbereitung von Stammlösungen
Biologische Aktivität
| Beschreibung | PNU-120596 (Nsc 216666) ist ein positiver allosterischer Modulator des α7 nAChR mit einem EC50 von 216 nM. | ||
|---|---|---|---|
| Ziele |
|
||
| In vitro | PNU-120596 erhöht den durch Agonist (Ach) ausgelösten Kalziumfluss, der durch eine gentechnisch veränderte Variante des humanen α7 nAChR vermittelt wird. Diese Verbindung erhöht die durch Agonisten (Cholin und ACh) ausgelösten Ströme, die durch Wildtyp-Rezeptoren vermittelt werden, und zeigt auch eine ausgeprägte Verlängerung der ausgelösten Reaktion in fortgesetzter Anwesenheit des Agonisten in Xenopus-Oozyten. Sie erhöht die mittlere Offenzeit der α7 nAChRs, hat aber keine Auswirkung auf die Ionen-Selektivität und relativ geringe, wenn überhaupt, Auswirkungen auf die Einzelleitfähigkeit. Bei Anwendung auf akute Hippocampus-Schnitten erhöht diese Chemikalie die Frequenz der ACh-ausgelösten GABAergen postsynaptischen Ströme, die in Pyramidenneuronen gemessen werden; dieser Effekt wird durch TTX unterdrückt, was darauf hindeutet, dass sie die Funktion von α7 nAChRs moduliert, die sich auf der somatodendritischen Membran von Hippocampus-Interneuronen befinden. Neben der positiven Modulation von α7 nAChR induziert diese Verbindung eine tiefgreifende Verzögerung der Kinetik der Desensibilisierung, was das Potenzial einer Ca2+-induzierten Toxizität durch übermäßige Stimulation von α7 nAChR erhöht. Sie verursacht Veränderungen der Cysteinzugänglichkeit am inneren Beta-Faltblatt, der Übergangszone und der Agonistenbindungsstelle, während sie an α7 nAChR bindet. Die Bindungsstellen für diese Chemikalie befinden sich nicht an den Agonistenbindungsstellen, und sie verstärkt die Agonisten-ausgelöste Gating von nikotinischen Rezeptoren, indem sie konformative Effekte hervorruft, die ähnlich, aber nicht identisch mit den durch Ach geförderten Gating-Konformationen sind. | ||
| In vivo | Die systemische Verabreichung von PNU-120596 (1 mg/kg) an Ratten verbessert das durch Amphetamin verursachte auditive Gating-Defizit, ein Modell, das eine Störung auf Schaltkreisebene im Zusammenhang mit Schizophrenie widerspiegeln soll. Bei Verabreichung vor Carrageenan schwächt 30 mg/kg dieser Verbindung die mechanische Hyperalgesie und die Beeinträchtigung der Gewichtsbelastung für bis zu 4 Stunden signifikant ab. Diese Chemikalie dämpft den durch Carrageenan induzierten Anstieg der TNF-α- und IL-6-Spiegel im Ödem der Hinterpfote, während Diclofenac nur die IL-6-Spiegel dämpfte. Eine etablierte mechanische Hyperalgesie, die durch Carrageenan oder CFA induziert wird, wird ebenfalls teilweise durch dieses Mittel umgekehrt. |
Protokoll (aus Referenz)
| Kinase-Assay:[1] |
|
|---|---|
| Zell-Assay:[2] |
|
| Tierstudie:[1] |
|
Referenzen
|
Kundenproduktvalidierung
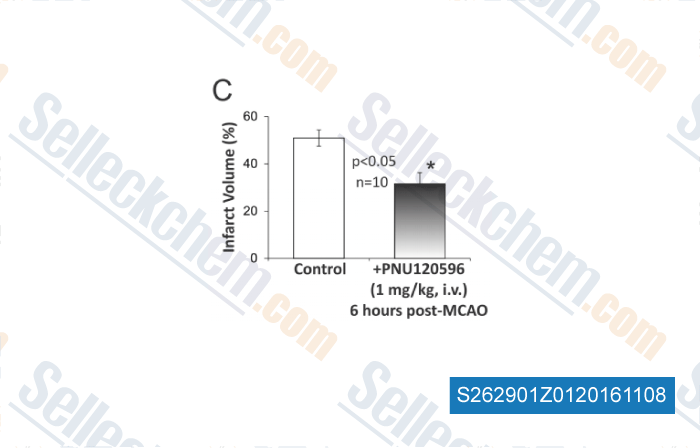
-
, , PLoS One, 2013, 8(8): e73581.
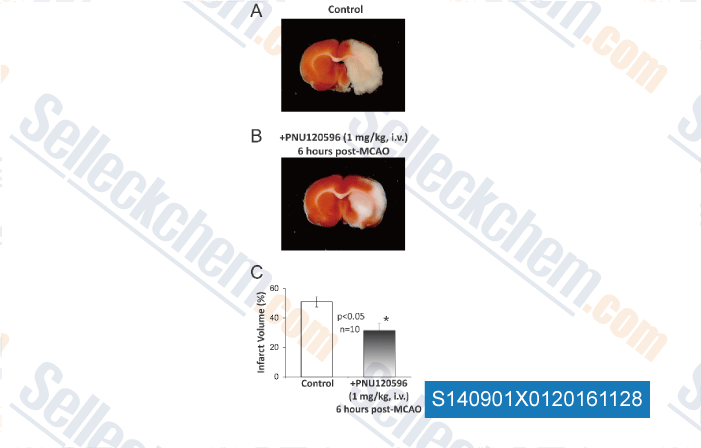
-
Daten von [ , , PLoS One, 2013, 8(8):e73581. ]
Sellecks PNU-120596 Wurde zitiert von 9 Publikationen
| Systemic Administration of α7-Nicotinic Acetylcholine Receptor Ligands Does Not Improve Renal Injury or Behavior in Mice With Advanced Systemic Lupus Erythematosus [ Front Med (Lausanne), 2021, 8:642960] | PubMed: 33928103 |
| Inhibitory effect of sinomenine on lung cancer cells via negative regulation of α7 nicotinic acetylcholine receptor [ J Leukoc Biol, 2020, 10.1002/JLB.6MA0720-344RRR] | PubMed: 32726882 |
| Alpha 7 nicotinic receptor agonist and positive allosteric modulators improved social and molecular deficits of MK-801 model of schizophrenia in rats. [ Pharmacol Biochem Behav, 2020, 10.1016/j.pbb.2020.172916] | PubMed: 32220620 |
| Investigating the Binding Interactions of NS6740, a Silent Agonist of the Nicotinic Receptor [ Mol Pharmacol, 2019, 10.1124/mol.119.116244] | PubMed: 31175182 |
| Boosting Endogenous Resistance of Brain to Ischemia. [Sun F, et al. Mol Neurobiol, 2017, 54(3):2045-2059] | PubMed: 26910820 |
| Boosting Endogenous Resistance of Brain to Ischemia [Sun F, et al. Mol Neurobiol, 2016, 10.1007/s12035-016-9796-3] | PubMed: 26910820 |
| An Unaltered Orthosteric Site and a Network of Long-Range Allosteric Interactions for PNU-120596 in α7 Nicotinic Acetylcholine Receptors [ Chem Biol, 2015, 22(8):1063-73] | PubMed: 26211363 |
| A positive allosteric modulator of α7 nAChRs augments neuroprotective effects of endogenous nicotinic agonists in cerebral ischaemia [ Br J Pharmacol, 2013, 169(8):1862-78] | PubMed: 23713819 |
| A Type-II Positive Allosteric Modulator of α7 nAChRs Reduces Brain Injury and Improves Neurological Function after Focal Cerebral Ischemia in Rats. [Sun F, et al. PLoS One, 2013, 8(8): e73581] | PubMed: 23951360 |
RÜCKGABERICHTLINIE
Die bedingungslose Rückgaberichtlinie von Selleck Chemical gewährleistet unseren Kunden ein reibungsloses Online-Einkaufserlebnis. Wenn Sie in irgendeiner Weise mit Ihrem Kauf unzufrieden sind, können Sie jeden Artikel innerhalb von 7 Tagen nach Erhalt zurückgeben. Im Falle von Produktqualitätsproblemen, sei es protokollbezogene oder produktbezogene Probleme, können Sie jeden Artikel innerhalb von 365 Tagen ab dem ursprünglichen Kaufdatum zurückgeben. Bitte befolgen Sie die nachstehenden Anweisungen, wenn Sie Produkte zurücksenden.
VERSAND UND LAGERUNG
Selleck-Produkte werden bei Raumtemperatur transportiert. Wenn Sie das Produkt bei Raumtemperatur erhalten, seien Sie versichert, dass die Qualitätskontrollabteilung von Selleck Experimente durchgeführt hat, um zu überprüfen, dass die normale Temperaturplatzierung von einem Monat die biologische Aktivität von Pulverprodukten nicht beeinträchtigt. Nach dem Sammeln lagern Sie das Produkt bitte gemäß den in der Datenblatt beschriebenen Anforderungen. Die meisten Selleck-Produkte sind unter den empfohlenen Bedingungen stabil.
NICHT FÜR DIE ANWENDUNG AM MENSCHEN, FÜR VETERINÄRMEDIZINISCHE DIAGNOSTIK ODER THERAPEUTISCHE ZWECKE.
