Technische Daten
| Formel | C15H16ClN5 |
||||||||||
| Molekulargewicht | 301.77 | CAS-Nr. | 172889-27-9 | ||||||||
| Löslichkeit (25°C)* | In vitro | DMSO | 60 mg/mL (198.82 mM) | ||||||||
| Ethanol | 2 mg/mL (6.62 mM) | ||||||||||
| Water | Insoluble | ||||||||||
| In vivo (Lösungsmittel einzeln und der Reihe nach zum Produkt hinzufügen.) |
|
||||||||||
|
* <1 mg/ml bedeutet schwer löslich oder unlöslich. * Bitte beachten Sie, dass Selleck die Löslichkeit aller Verbindungen intern testet und die tatsächliche Löslichkeit geringfügig von veröffentlichten Werten abweichen kann. Dies ist normal und ist auf geringfügige Batch-zu-Batch-Variationen zurückzuführen. * Versand bei Raumtemperatur (Stabilitätstests zeigen, dass dieses Produkt ohne Kühlmaßnahmen versendet werden kann.) |
|||||||||||
Vorbereitung von Stammlösungen
Biologische Aktivität
| Beschreibung | PP2 (AG 1879, AGL 1879), ein Src-Familien-Kinase-Inhibitor, hemmt Lck/Fyn in zellfreien Assays potent mit einer IC50 von 4 nM/5 nM, ist etwa 100-fach weniger potent gegenüber EGFR und inaktiv für ZAP-70, JAK2 und PKA. | ||||
|---|---|---|---|---|---|
| Ziele |
|
||||
| In vitro | PP2 hemmt Src, indem es an einen Bereich des Moleküls bindet, der sich nicht mit der ATP-Bindungsdomäne überschneidet. Diese Verbindung (20 μM) induziert eine 40-50%ige Wachstumshemmung von HT29-Zellen; diese Konzentration reduziert die Src-Aktivität bereits nach 1 Stunde und hält eine 35%ige Hemmung der Src-Aktivität für 2 Tage aufrecht. Es (100 mM) verringert die Src-Aktivität von HT29-Zellen dosisabhängig. Diese Chemikalie (1 mM-100 mM) verursacht eine dosisabhängige Wachstumshemmung von menschlichen Darmkrebszellen (HT29, SW480 und PMCO1), Leberkrebszellen (PLC/PRF/5, KYN-2, Li7 und HepG2) und Brustkrebszellen (MCF-7, MDA-MB-468 und BT-474). Es (20 μM) erhöht die Aggregation in den meisten Krebszellen (HT29, SW480, PMCO1, PLC/PRF/5, KYN-2, Li7, MCF-7 und MDA-MB-468) auf E-Cadherin-abhängige Weise signifikant. Diese Verbindung (20 μM) verstärkt die E-Cadherin-Expression und erhöht auch stark die Assoziation von E-Cadherin mit dem Aktin-Zytoskelett in Krebszellen. Es (20 μM) erhöht die Expression von α-Catenin, β-Catenin und γ-Catenin in HT29-Zellen, während in PLC/PRF/5- und MCF-7-Zellen der Gesamtproteingehalt von α-Catenin unverändert bleibt, aber die Spiegel von β-Catenin und γ-Catenin leicht ansteigen. Dieser Inhibitor hemmt die Proliferation von zwei Gebärmutterhalskrebszellen (HeLa und SiHa) zeit- und dosisabhängig. Es (10 μM) reguliert die Expressionsniveaus von pSrc-Y416, pEGFR-Y845 und -Y1173 in HeLa- und SiHa-Zellen herunter. Diese Chemikalie (10 μM) könnte den Zellzyklusarrest modulieren, indem sie p21(Cip1) und p27(Kip1) in beiden HeLa- und SiHa-Zellen hochreguliert und die Expression von Cyclin A und Cyclin-abhängiger Kinase-2, -4 (Cdk-2, -4) in HeLa und von Cyclin B und Cdk-2 in SiHa herunterreguliert. |
||||
| In vivo | PP2 (5 mg/kg/Tag) induziert eine leichte Verlangsamung der Wachstumsrate der Primärtumoren im Vergleich zur Kontrolle, die mit Vehikel behandelt wurde, bei SCID-Mäusen, denen HT29-Zellen in die Milz injiziert wurden. Diese Verbindung induziert eine leichte Verlangsamung der Wachstumsrate der Primärtumoren im Vergleich zur Kontrolle, die mit Vehikel behandelt wurde, bei SCID-Mäusen, denen HT29-Zellen in die Milz injiziert wurden. Diese Chemikalie reduziert das relative Lebergewicht und das Lebermetastasierungsvolumen signifikant im Vergleich zu den Kontrollen bei SCID-Mäusen, denen HT29-Zellen in die Milz injiziert wurden. Mit dieser Verbindung (1,5 mg/kg i.p.) behandelte Ratten zeigen eine Reduzierung der Infarktgröße um etwa 50% auf T2-gewichteter MRT und in der TTC-Färbung im Vergleich zu Kontrollen bei Ratten mit fokaler ischämischer Hirnverletzung. Diese Chemikalie führt zu einem besseren neurologischen Ergebnis als Kontrollen bei Ratten mit fokaler ischämischer Hirnverletzung. |
Protokoll (aus Referenz)
| Kinase-Assay: |
|
|---|---|
| Zell-Assay: |
|
| Tierstudie: |
|
Referenzen
|
Kundenproduktvalidierung

-
Daten von [ , , J Biol Chem, 2014, 289(19): 13026-41 ]

-
Daten von [ , , CNS Neurosci Ther, 2017, 23(4):291-300 ]
-
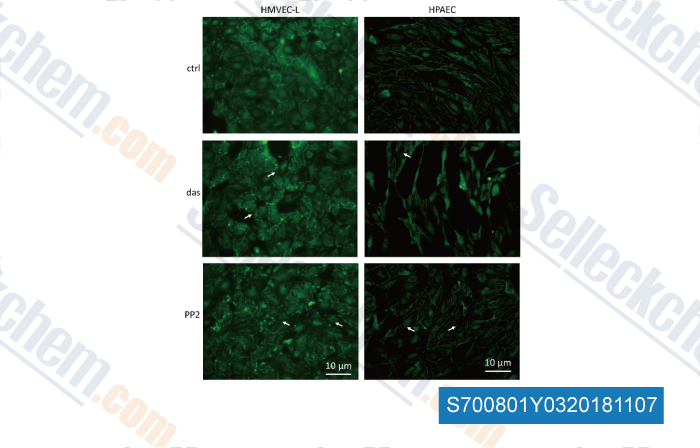
Daten von [ , , Front Physiol, 2018, 9: 537 ]
Sellecks PP2 (AGL 1879) Wurde zitiert von 128 Publikationen
| VCP downstream metabolite glycerol-3-phosphate (G3P) inhibits CD8+T cells function in the HCC microenvironment [ Signal Transduct Target Ther, 2025, 10(1):26] | PubMed: 39848960 |
| Intrinsic p53 activation restricts gammaherpesvirus driven germinal center B cell expansion during latency establishment [ Nat Commun, 2025, 16(1):951] | PubMed: 39843898 |
| TBK1 phagosomal recruitment enhances antifungal immunity via positive feedback regulation with SRC [ Cell Rep, 2025, 44(7):115972] | PubMed: 40638388 |
| Activation of integrin signaling up-regulates pro-inflammatory cytokines in JAK2-V617F positive hematopoietic cells [ Cell Commun Signal, 2025, 23(1):368] | PubMed: 40790213 |
| Anthrax ET activates Rac1 and RTK signaling to induce F-actin reorganization and endothelial permeability [ iScience, 2025, 28(11):113682] | PubMed: 41158867 |
| ICAM-1-mediated Src signaling pathway plays a pivotal role in encephalomyocarditis virus entry [ J Virol, 2025, 99(8):e0071525] | PubMed: 40631914 |
| Asiaticoside enhances the anti-tumor effect of anti-PDL1 by regulating T cell activity through increasing LCK activity [ Pathol Res Pract, 2025, 271:155995] | PubMed: 40373489 |
| Identification of hypoxic macrophages in glioblastoma with therapeutic potential for vasculature normalization [ Cancer Cell, 2024, S1535-6108(24)00119-3] | PubMed: 38640932 |
| Defective N-glycosylation of IL6 induces metastasis and tyrosine kinase inhibitor resistance in lung cancer [ Nat Commun, 2024, 15(1):7885] | PubMed: 39251588 |
| Guided monocyte fate to FRβ/CD163+ S1 macrophage antagonises atopic dermatitis via fibroblastic matrices in mouse hypodermis [ Cell Mol Life Sci, 2024, 82(1):14] | PubMed: 39720957 |
RÜCKGABERICHTLINIE
Die bedingungslose Rückgaberichtlinie von Selleck Chemical gewährleistet unseren Kunden ein reibungsloses Online-Einkaufserlebnis. Wenn Sie in irgendeiner Weise mit Ihrem Kauf unzufrieden sind, können Sie jeden Artikel innerhalb von 7 Tagen nach Erhalt zurückgeben. Im Falle von Produktqualitätsproblemen, sei es protokollbezogene oder produktbezogene Probleme, können Sie jeden Artikel innerhalb von 365 Tagen ab dem ursprünglichen Kaufdatum zurückgeben. Bitte befolgen Sie die nachstehenden Anweisungen, wenn Sie Produkte zurücksenden.
VERSAND UND LAGERUNG
Selleck-Produkte werden bei Raumtemperatur transportiert. Wenn Sie das Produkt bei Raumtemperatur erhalten, seien Sie versichert, dass die Qualitätskontrollabteilung von Selleck Experimente durchgeführt hat, um zu überprüfen, dass die normale Temperaturplatzierung von einem Monat die biologische Aktivität von Pulverprodukten nicht beeinträchtigt. Nach dem Sammeln lagern Sie das Produkt bitte gemäß den in der Datenblatt beschriebenen Anforderungen. Die meisten Selleck-Produkte sind unter den empfohlenen Bedingungen stabil.
NICHT FÜR DIE ANWENDUNG AM MENSCHEN, FÜR VETERINÄRMEDIZINISCHE DIAGNOSTIK ODER THERAPEUTISCHE ZWECKE.
