Technische Daten
| Formel | C21H16ClF3N4O3 |
||||||
| Molekulargewicht | 464.82 | CAS-Nr. | 284461-73-0 | ||||
| Löslichkeit (25°C)* | In vitro | DMSO | 92 mg/mL (197.92 mM) | ||||
| Water | Insoluble | ||||||
| Ethanol | Insoluble | ||||||
| In vivo (Lösungsmittel einzeln und der Reihe nach zum Produkt hinzufügen.) |
|
||||||
|
* <1 mg/ml bedeutet schwer löslich oder unlöslich. * Bitte beachten Sie, dass Selleck die Löslichkeit aller Verbindungen intern testet und die tatsächliche Löslichkeit geringfügig von veröffentlichten Werten abweichen kann. Dies ist normal und ist auf geringfügige Batch-zu-Batch-Variationen zurückzuführen. * Versand bei Raumtemperatur (Stabilitätstests zeigen, dass dieses Produkt ohne Kühlmaßnahmen versendet werden kann.) |
|||||||
Vorbereitung von Stammlösungen
Biologische Aktivität
| Beschreibung | Sorafenib ist ein Multikinase-Inhibitor von Raf-1 und B-Raf mit einer IC50 von 6 nM bzw. 22 nM in zellfreien Assays. Sorafenib hemmt VEGFR-2, VEGFR-3, PDGFR-β, Flt-3 und c-KIT mit einer IC50 von 90 nM, 20 nM, 57 nM, 59 nM bzw. 68 nM. Sorafenib induziert Autophagy und Apoptosis und aktiviert Ferroptosis mit Antitumoraktivität. | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Ziele |
|
|||||||||||
| In vitro | Sorafenib hemmt sowohl die Wildtyp- als auch die V599E-Mutanten-B-Raf-Aktivität mit einer IC50 von 22 nM bzw. 38 nM. Diese Verbindung hemmt auch potent mVEGFR2 (Flk-1), mVEGFR3, mPDGFRβ, Flt3 und c-Kit mit einer IC50 von 15 nM, 20 nM, 57 nM, 58 nM bzw. 68 nM. Es hemmt schwach FGFR-1 mit einer IC50 von 580 nM. Diese Chemikalie ist nicht aktiv gegen ERK-1, MEK-1, EGFR, HER-2, IGFR-1, c-Met, PKB, PKA, cdk1/cyclinB, PKCα, PKCγ und pim-1. Es hemmt deutlich die VEGFR2-Phosphorylierung in NIH 3T3-Zellen mit einer IC50 von 30 nM und die Flt-3-Phosphorylierung in HEK-293-Zellen mit einer IC50 von 20 nM. Dieser Wirkstoff blockiert potent die MEK 1/2- und ERK 1/2-Phosphorylierung in den meisten Zelllinien, jedoch nicht in A549- oder H460-Zellen, während er keine Auswirkung auf die Hemmung des PKB-Signalwegs hat. Es hemmt die Proliferation von HAoSMC- und MDA-MB-231-Zellen mit einer IC50 von 0,28 μM bzw. 2,6 μM. Zusätzlich zur Hemmung des RAF/MEK/ERK-Signalwegs hemmt diese Verbindung signifikant die Phosphorylierung von eIF4E und reguliert die Mcl-1-Spiegel in hepatozellulären Karzinomzellen (HCC) auf eine MEK/ERK-unabhängige Weise herunter. Es hemmt die Proliferation von PLC/PRF/5- und HepG2-Zellen mit einer IC50 von 6,3 μM bzw. 4,5 μM und führt zur signifikanten Induktion von Apoptosis. | |||||||||||
| In vivo | Orale Verabreichung von Sorafenib (~60 mg/kg) zeigt ein breites Spektrum an dosisabhängiger Antitumoraktivität gegen eine Vielzahl menschlicher Tumor-Xenograft-Modelle, darunter MDA-MB-231, Colo-205, HT-29, DLD-1, NCI-H460 und A549, ohne Anzeichen von Toxizität. In Verbindung mit der Antitumorwirksamkeit hemmt diese Verbindung potenziell die MEK 1/2-Phosphorylierung und die pERK 1/2-Spiegel in HT-29- und MDA-MB-231-Xenografts, jedoch nicht in Colo-205-Xenografts, und unterdrückt signifikant die mikrovaskuläre Fläche (MVA) und die Mikrovaskulardichte (MVD) in MDA MB-231-, HT-29- und Colo-205-Tumor-Xenografts. Dieser Wirkstoff bewirkt eine dosisabhängige Wachstumshemmung von PLC/PRF/5-Tumor-Xenografts in SCID-Mäusen mit TGIs von 49% und 78% bei 10 mg/kg bzw. 30 mg/kg, was mit der Hemmung der ERK- und eIF4E-Phosphorylierung, der Reduktion der Mikrovaskularfläche und der Induktion von Tumorzell-Apoptosis übereinstimmt. Es sensibilisiert bax-/--Zellen dosisabhängig gegenüber TRAIL durch einen Mechanismus, der die Herunterregulierung der NF-κB-vermittelten Mcl-1- und cIAP2-Expression beinhaltet. Die Kombination dieser Verbindung (30-60 mg/kg) mit TRAIL (5 mg/kg) zeigt eine dramatische Wirksamkeit bei TRAIL-resistenten HCT116 bax-/-- und HT29-Tumor-Xenografts. |
Protokoll (aus Referenz)
| Kinase-Assay: |
|
|---|---|
| Zell-Assay: |
|
| Tierstudie: |
|
Referenzen
|
Kundenproduktvalidierung
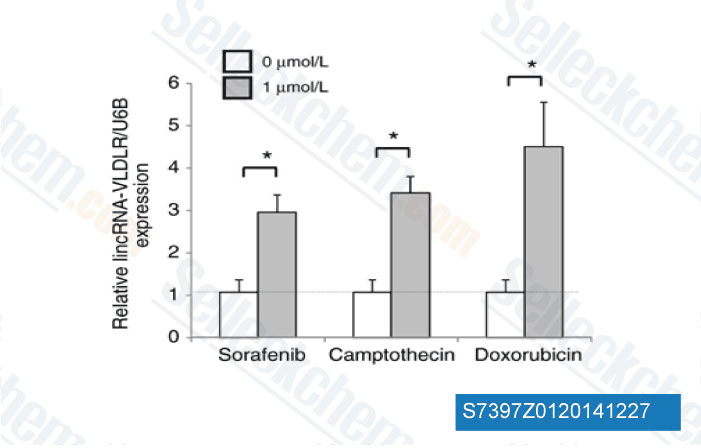
-
Daten von [ Mol Cancer Res , 2014 , 12(10), 1377-87 ]
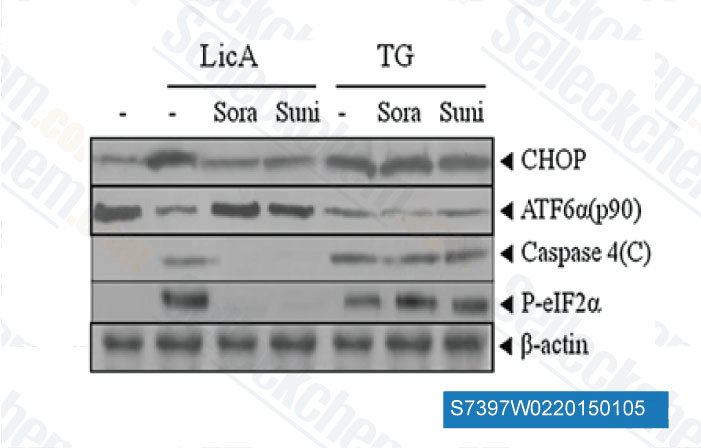
-
Daten von [ Apoptosis , 2014 , 19(4), 682-97 ]
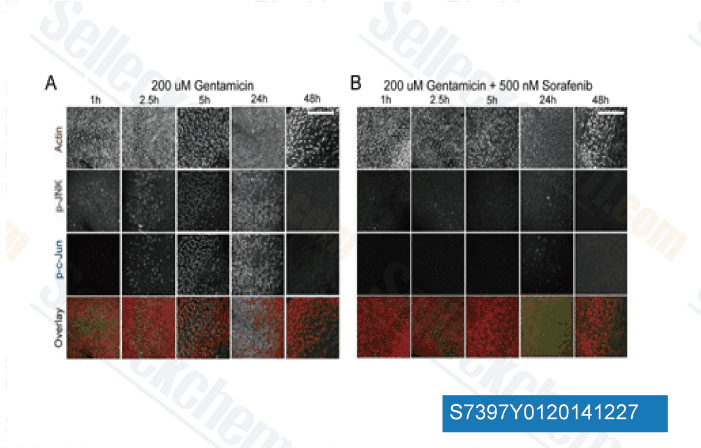
-
Daten von [ J Neurosci , 2013 , 33(7), 3079-93 ]
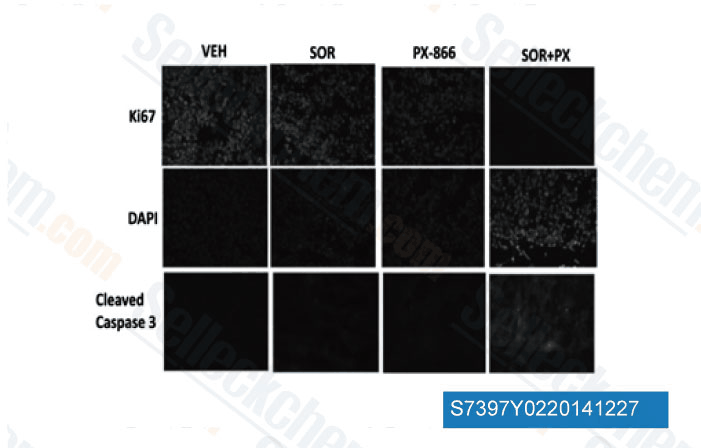
-
Daten von [ Mol Pharmacol , 2013 , 84(4), 562-71 ]
Sellecks Sorafenib (BAY 43-9006) Wurde zitiert von 599 Publikationen
| Sorafenib enhanced the function of myeloid-derived suppressor cells in hepatocellular carcinoma by facilitating PPARα-mediated fatty acid oxidation [ Mol Cancer, 2025, 24(1):34] | PubMed: 39876004 |
| S100P is a ferroptosis suppressor to facilitate hepatocellular carcinoma development by rewiring lipid metabolism [ Nat Commun, 2025, 16(1):509] | PubMed: 39779666 |
| PIP5K1A Suppresses Ferroptosis and Induces Sorafenib Resistance by Stabilizing NRF2 in Hepatocellular Carcinoma [ Adv Sci (Weinh), 2025, 12(30):e04372] | PubMed: 40405713 |
| Injectable SF-platform orchestrates GPX4-targeted ferroptosis-autophagy-immunogenic circuit for overcoming oxidative resistance in triple-negative breast cancer [ Theranostics, 2025, 15(17):8757-8778] | PubMed: 40963899 |
| FLT3 inhibitors induce p53 instability, driven by STAT5/MDM2/p53 competitive interactions in acute myeloid leukemia [ Cancer Lett, 2025, 611:217446] | PubMed: 39756787 |
| In vivo optoacoustic imaging of endothelin receptor expression and treatment response in the hypoxic tumor microenvironment [ Eur J Nucl Med Mol Imaging, 2025, 10.1007/s00259-025-07494-7] | PubMed: 40802092 |
| Matrix stiffness regulates glucose-6-phosphate dehydrogenase expression to mediate sorafenib resistance in hepatocellular carcinoma through the ITGB1-PI3K/AKT pathway [ Cell Death Dis, 2025, 16(1):538] | PubMed: 40685383 |
| Inhibition of Wnt/β-catenin increases anti-tumor activity by synergizing with sorafenib in hepatocellular carcinoma [ Cell Death Dis, 2025, 16(1):466] | PubMed: 40593458 |
| Targeting PTGDS Promotes ferroptosis in peripheral T cell lymphoma through regulating HMOX1-mediated iron metabolism [ Br J Cancer, 2025, 132(4):384-400] | PubMed: 39706989 |
| Targeting the MYC oncogene with a selective bi-steric mTORC1 inhibitor elicits tumor regression in MYC-driven cancers [ Cell Chem Biol, 2025, 32(8):994-1012.e11] | PubMed: 40803322 |
RÜCKGABERICHTLINIE
Die bedingungslose Rückgaberichtlinie von Selleck Chemical gewährleistet unseren Kunden ein reibungsloses Online-Einkaufserlebnis. Wenn Sie in irgendeiner Weise mit Ihrem Kauf unzufrieden sind, können Sie jeden Artikel innerhalb von 7 Tagen nach Erhalt zurückgeben. Im Falle von Produktqualitätsproblemen, sei es protokollbezogene oder produktbezogene Probleme, können Sie jeden Artikel innerhalb von 365 Tagen ab dem ursprünglichen Kaufdatum zurückgeben. Bitte befolgen Sie die nachstehenden Anweisungen, wenn Sie Produkte zurücksenden.
VERSAND UND LAGERUNG
Selleck-Produkte werden bei Raumtemperatur transportiert. Wenn Sie das Produkt bei Raumtemperatur erhalten, seien Sie versichert, dass die Qualitätskontrollabteilung von Selleck Experimente durchgeführt hat, um zu überprüfen, dass die normale Temperaturplatzierung von einem Monat die biologische Aktivität von Pulverprodukten nicht beeinträchtigt. Nach dem Sammeln lagern Sie das Produkt bitte gemäß den in der Datenblatt beschriebenen Anforderungen. Die meisten Selleck-Produkte sind unter den empfohlenen Bedingungen stabil.
NICHT FÜR DIE ANWENDUNG AM MENSCHEN, FÜR VETERINÄRMEDIZINISCHE DIAGNOSTIK ODER THERAPEUTISCHE ZWECKE.
