Technische Daten
| Formel | C22H27FN4O2 |
||||||||||
| Molekulargewicht | 398.47 | CAS-Nr. | 557795-19-4 | ||||||||
| Löslichkeit (25°C)* | In vitro | DMSO | 80 mg/mL (200.76 mM) | ||||||||
| Ethanol | 26 mg/mL (65.24 mM) | ||||||||||
| Water | Insoluble | ||||||||||
| In vivo (Lösungsmittel einzeln und der Reihe nach zum Produkt hinzufügen.) |
|
||||||||||
|
* <1 mg/ml bedeutet schwer löslich oder unlöslich. * Bitte beachten Sie, dass Selleck die Löslichkeit aller Verbindungen intern testet und die tatsächliche Löslichkeit geringfügig von veröffentlichten Werten abweichen kann. Dies ist normal und ist auf geringfügige Batch-zu-Batch-Variationen zurückzuführen. * Versand bei Raumtemperatur (Stabilitätstests zeigen, dass dieses Produkt ohne Kühlmaßnahmen versendet werden kann.) |
|||||||||||
Vorbereitung von Stammlösungen
Biologische Aktivität
| Beschreibung | Sunitinib ist ein Multi-Targeted RTK-Inhibitor, der VEGFR2 (Flk-1) und PDGFRβ mit einer IC50 von 80 nM bzw. 2 nM hemmt und auch c-Kit inhibiert. Sunitinib ist auch ein dosisabhängiger Inhibitor der Autophosphorylierungsaktivität von IRE1α. Sunitinib induziert Autophagy und Apoptose. | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| Ziele |
|
||||||||
| In vitro | Sunitinib hemmt auch Kit und FLT-3 stark. Diese Verbindung ist ein potenter ATP-kompetitiver Inhibitor von VEGFR2 (Flk1) und PDGFRβ mit Ki von 9 nM bzw. 8 nM, wobei sie eine >10-fach höhere Selektivität für VEGFR2 und PDGFR als FGFR-1, EGFR, Cdk2, Met, IGFR-1, Abl und src zeigt. In serumdeprivierten NIH-3T3-Zellen, die VEGFR2 oder PDGFRβ exprimieren, hemmt es die VEGF-abhängige VEGFR2-Phosphorylierung und die PDGF-abhängige PDGFRβ-Phosphorylierung mit einer IC50 von jeweils 10 nM. Diese Chemikalie hemmt die VEGF-induzierte Proliferation von serumdeprivierten HUVECs mit einer IC50 von 40 nM und hemmt die PDGF-induzierte Proliferation von NIH-3T3-Zellen, die PDGFRβ oder PDGFRα überexprimieren, mit einer IC50 von 39 nM bzw. 69 nM. Es hemmt die Phosphorylierung von Wildtyp-FLT3, FLT3-ITD und FLT3-Asp835 mit einer IC50 von 250 nM, 50 nM bzw. 30 nM. Dieser Inhibitor hemmt die Proliferation von MV4;11- und OC1-AML5-Zellen mit einer IC50 von 8 nM bzw. 14 nM und induziert Apoptose dosisabhängig. | ||||||||
| In vivo | Konsistent mit der substanziellen und selektiven Hemmung der VEGFR2- oder PDGFR-Phosphorylierung und -Signalisierung in vivo zeigt Sunitinib (20-80 mg/kg/Tag) eine breite und potente dosisabhängige Antitumoraktivität gegen eine Vielzahl von Tumorxenograftmodellen, einschließlich HT-29, A431, Colo205, H-460, SF763T, C6, A375 oder MDA-MB-435. Die Behandlung mit dieser Verbindung in einer Dosis von 80 mg/kg/Tag über 21 Tage führt zu einer vollständigen Tumorrückbildung bei sechs von acht Mäusen, ohne Tumorwachstum während einer 110-tägigen Beobachtungsperiode nach Behandlungsende. Eine zweite Behandlungsrunde mit dieser Verbindung bleibt wirksam gegen Tumoren, die während der ersten Behandlungsrunde nicht vollständig zurückgebildet wurden. Die Behandlung mit dieser Verbindung führt zu einer signifikanten Abnahme der Tumor-MVD mit einer Reduktion von ~40 % bei SF763T-Gliomtumoren. Die SU11248-Behandlung führt zu einer vollständigen Hemmung des zusätzlichen Tumorwachstums von Luziferase-exprimierenden PC-3M-Xenografts, trotz keiner Reduzierung der Tumorgröße. Die Behandlung mit dieser Verbindung (20 mg/kg/Tag) unterdrückt dramatisch das Wachstum subkutaner MV4;11 (FLT3-ITD)-Xenografts und verlängert das Überleben im FLT3-ITD-Knochenmark-Engraftmentmodell. |
Protokoll (aus Referenz)
| Kinase-Assay: |
|
|---|---|
| Zell-Assay: |
|
| Tierstudie: |
|
Referenzen
|
Kundenproduktvalidierung
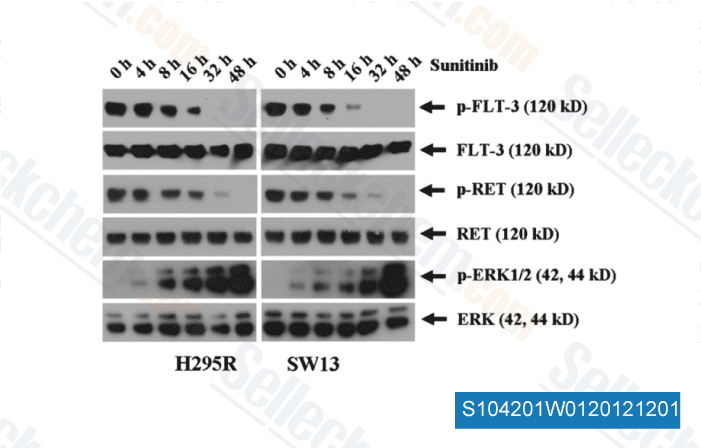
-
Daten von [ Surgery , 2012 , 152, 1045-50 ]
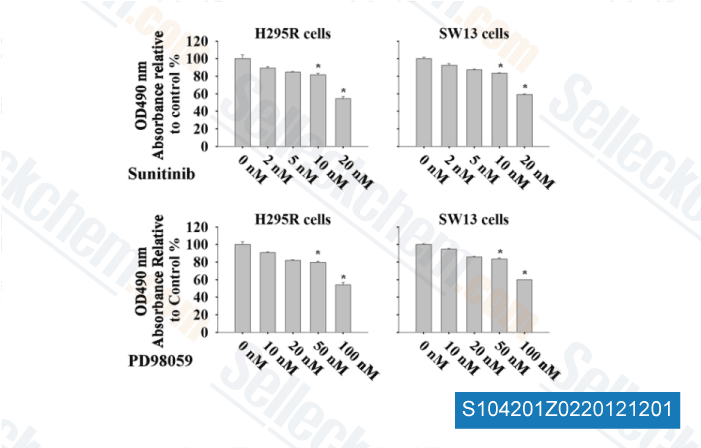
-
Daten von [ Surgery , 2012 , 152, 1045-50 ]
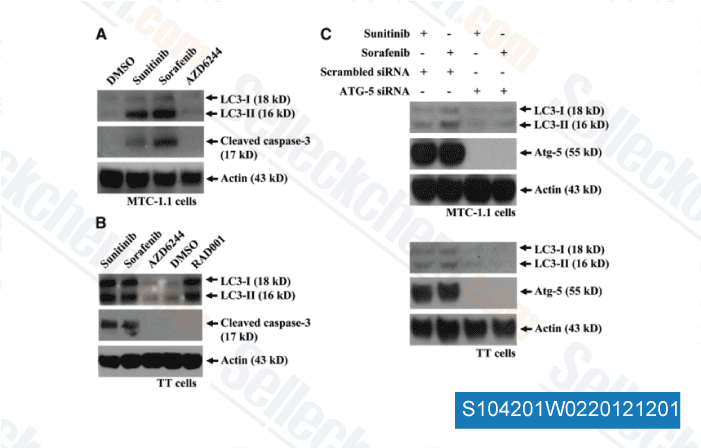
-
Daten von [ Surgery , 2012 , 152, 1142-9 ]
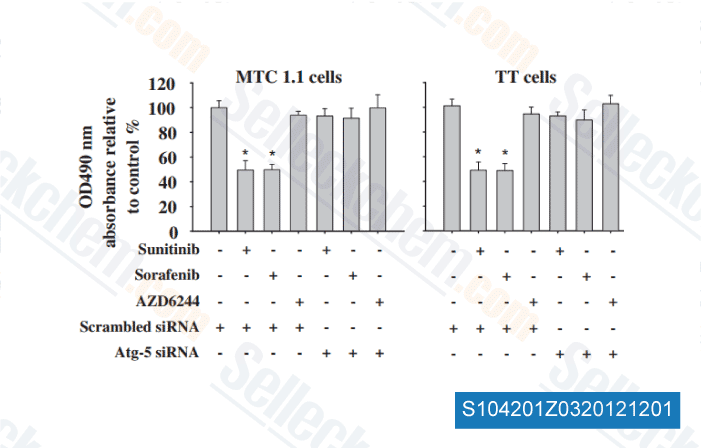
-
Daten von [ Surgery , 2012 , 152, 1142-9 ]
Sellecks Sunitinib (SU-11248) Wurde zitiert von 257 Publikationen
| Proteogenomic characterization of non-functional pancreatic neuroendocrine tumors unravels clinically relevant subgroups [ Cancer Cell, 2025, 43(4):776-796.e14] | PubMed: 40185092 |
| Single-cell multi-omics reveals that FABP1 + renal cell carcinoma drive tumor angiogenesis through the PLG-PLAT axis under fatty acid reprogramming [ Mol Cancer, 2025, 24(1):179] | PubMed: 40518526 |
| Multi-layer stratified oncology platform utilizing transcriptomics, prostate cancer organoids, and modeling of drug response [ J Exp Clin Cancer Res, 2025, 44(1):290] | PubMed: 41094672 |
| O-GlcNAcylation of UBAP2L regulates stress granule formation and sunitinib resistance in clear cell renal cell carcinoma [ J Exp Clin Cancer Res, 2025, 44(1):273] | PubMed: 41029457 |
| The novel hydrogen-PT2385-silncARSR nanocomplex impairs tumor angiogenesis and mitochondrial activity in sunitinib-resistant renal cancer [ Mater Today Bio, 2025, 35:102450] | PubMed: 41235366 |
| Unveiling the Anti-Angiogenic Potential of Small-Molecule (Kinase) Inhibitors for Application in Rheumatoid Arthritis [ Cells, 2025, 14(2)102] | PubMed: 39851530 |
| Baicalin reduces sunitinib-induced cardiotoxicity in renal carcinoma PDX model by inhibiting myocardial injury, apoptosis and fibrosis [ Front Pharmacol, 2025, 16:1563194] | PubMed: 40264678 |
| Kinomic profiling to predict sunitinib response of patients with metastasized clear cell Renal Cell Carcinoma [ Neoplasia, 2025, 60:101108] | PubMed: 39724752 |
| CYP1B1 promotes angiogenesis and sunitinib resistance in clear cell renal cell carcinoma via USP5-mediated HIF2α deubiquitination [ Neoplasia, 2025, 66:101186] | PubMed: 40435846 |
| Hyperpolarized [1-13C]pyruvate NMR spectroscopy reveals transition of tumor energy metabolism in microscale multicellular spheroids [ Sci Rep, 2025, 15(1):19303] | PubMed: 40456829 |
RÜCKGABERICHTLINIE
Die bedingungslose Rückgaberichtlinie von Selleck Chemical gewährleistet unseren Kunden ein reibungsloses Online-Einkaufserlebnis. Wenn Sie in irgendeiner Weise mit Ihrem Kauf unzufrieden sind, können Sie jeden Artikel innerhalb von 7 Tagen nach Erhalt zurückgeben. Im Falle von Produktqualitätsproblemen, sei es protokollbezogene oder produktbezogene Probleme, können Sie jeden Artikel innerhalb von 365 Tagen ab dem ursprünglichen Kaufdatum zurückgeben. Bitte befolgen Sie die nachstehenden Anweisungen, wenn Sie Produkte zurücksenden.
VERSAND UND LAGERUNG
Selleck-Produkte werden bei Raumtemperatur transportiert. Wenn Sie das Produkt bei Raumtemperatur erhalten, seien Sie versichert, dass die Qualitätskontrollabteilung von Selleck Experimente durchgeführt hat, um zu überprüfen, dass die normale Temperaturplatzierung von einem Monat die biologische Aktivität von Pulverprodukten nicht beeinträchtigt. Nach dem Sammeln lagern Sie das Produkt bitte gemäß den in der Datenblatt beschriebenen Anforderungen. Die meisten Selleck-Produkte sind unter den empfohlenen Bedingungen stabil.
NICHT FÜR DIE ANWENDUNG AM MENSCHEN, FÜR VETERINÄRMEDIZINISCHE DIAGNOSTIK ODER THERAPEUTISCHE ZWECKE.
