Technische Daten
| Formel | C22H27FN4O2.C4H6O5 |
||||||||||
| Molekulargewicht | 532.56 | CAS-Nr. | 341031-54-7 | ||||||||
| Löslichkeit (25°C)* | In vitro | DMSO | 70 mg/mL (131.44 mM) | ||||||||
| Water | Insoluble | ||||||||||
| Ethanol | Insoluble | ||||||||||
| In vivo (Lösungsmittel einzeln und der Reihe nach zum Produkt hinzufügen.) |
|
||||||||||
|
* <1 mg/ml bedeutet schwer löslich oder unlöslich. * Bitte beachten Sie, dass Selleck die Löslichkeit aller Verbindungen intern testet und die tatsächliche Löslichkeit geringfügig von veröffentlichten Werten abweichen kann. Dies ist normal und ist auf geringfügige Batch-zu-Batch-Variationen zurückzuführen. * Versand bei Raumtemperatur (Stabilitätstests zeigen, dass dieses Produkt ohne Kühlmaßnahmen versendet werden kann.) |
|||||||||||
Vorbereitung von Stammlösungen
Biologische Aktivität
| Beschreibung | Sunitinib malate ist ein Multi-Target-RTK-Inhibitor, der VEGFR2 (Flk-1) und PDGFRβ mit einer IC50 von 80 nM bzw. 2 nM in zellfreien Assays hemmt und auch c-Kit inhibiert. Sunitinib Malate hemmt effektiv die Autophosphorylierung von Ire1α. Sunitinib Malate erhöht sowohl den Todesrezeptor als auch die mitochondrienabhängige Apoptose. | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Ziele |
|
||||||||||
| In vitro | Sunitinib hemmt auch Kit und FLT-3 stark. Sunitinib ist ein potenter ATP-kompetitiver Inhibitor von VEGFR2 (Flk1) und PDGFRβ mit Ki von 9 nM bzw. 8 nM, der eine >10-fach höhere Selektivität für VEGFR2 und PDGFR als für FGFR-1, EGFR, Cdk2, Met, IGFR-1, Abl und src aufweist. In Serum-entzugenen NIH-3T3-Zellen, die VEGFR2 oder PDGFRβ exprimieren, hemmt Sunitinib die VEGF-abhängige VEGFR2-Phosphorylierung und die PDGF-abhängige PDGFRβ-Phosphorylierung mit einer IC50 von 10 nM bzw. 10 nM. Sunitinib hemmt die VEGF-induzierte Proliferation von Serum-entzugenen HUVECs mit einer IC50 von 40 nM und hemmt die PDGF-induzierte Proliferation von NIH-3T3-Zellen, die PDGFRβ oder PDGFRα überexprimieren, mit einer IC50 von 39 nM bzw. 69 nM. Sunitinib hemmt die Phosphorylierung von Wildtyp FLT3, FLT3-ITD und FLT3-Asp835 mit einer IC50 von 250 nM, 50 nM bzw. 30 nM. Sunitinib hemmt die Proliferation von MV4;11- und OC1-AML5-Zellen mit einer IC50 von 8 nM bzw. 14 nM und induziert Apoptose dosisabhängig. |
||||||||||
| In vivo | In Übereinstimmung mit der erheblichen und selektiven Hemmung der VEGFR2- oder PDGFR-Phosphorylierung und -Signalübertragung in vivo zeigt Sunitinib (20-80 mg/kg/Tag) eine breite und potente dosisabhängige Antitumoraktivität gegen eine Vielzahl von Tumor-Xenograft-Modellen, darunter HT-29, A431, Colo205, H-460, SF763T, C6, A375 oder MDA-MB-435. Die Sunitinib-Dosierung von 80 mg/kg/Tag über 21 Tage führt zu einer vollständigen Tumorregression bei sechs von acht Mäusen, ohne Tumorwachstum während einer 110-tägigen Beobachtungsperiode nach Behandlungsende. Eine zweite Behandlungsrunde mit Sunitinib bleibt wirksam gegen Tumoren, die während der ersten Behandlungsrunde nicht vollständig zurückgegangen sind. Die Sunitinib-Behandlung führt zu einem signifikanten Rückgang der Tumor-MVD, mit einer ~40%igen Reduktion bei SF763T-Gliomtumoren. Die SU11248-Behandlung führt zu einer vollständigen Hemmung des zusätzlichen Tumorwachstums von Luziferase-exprimierenden PC-3M-Xenografts, trotz keiner Reduktion der Tumorgröße. Die Sunitinib-Behandlung (20 mg/kg/Tag) unterdrückt dramatisch das Wachstum von subkutanen MV4;11 (FLT3-ITD)-Xenografts und verlängert das Überleben im FLT3-ITD-Knochenmarktransplantationsmodell. |
Protokoll (aus Referenz)
| Kinase-Assay: |
|
|---|---|
| Zell-Assay: |
|
| Tierstudie: |
|
Referenzen
|
Kundenproduktvalidierung
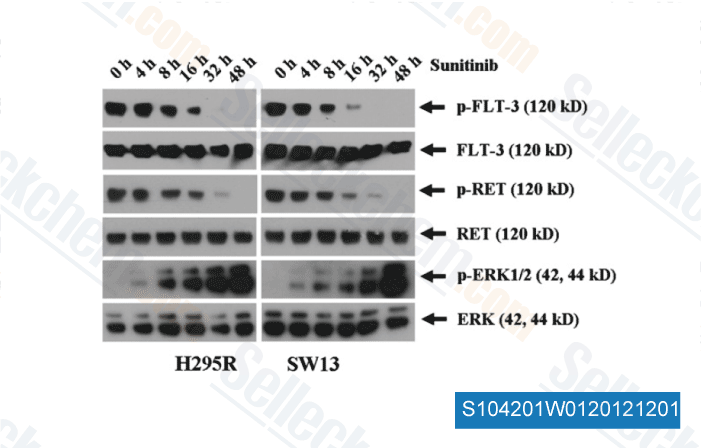
-
Daten von [ Surgery , 2012 , 152, 1045-50 ]
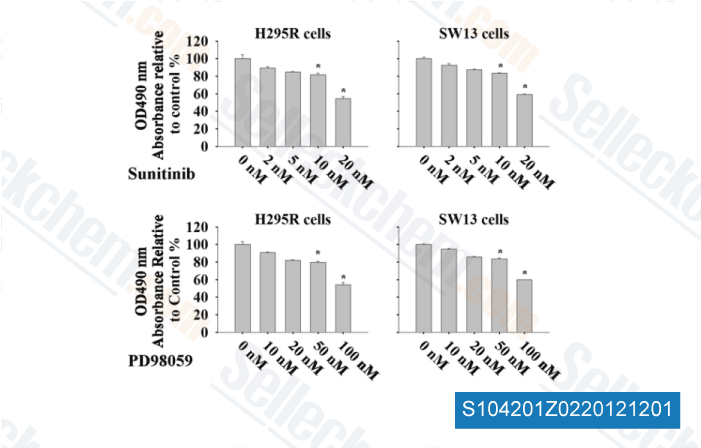
-
Daten von [ Surgery , 2012 , 152, 1045-50 ]
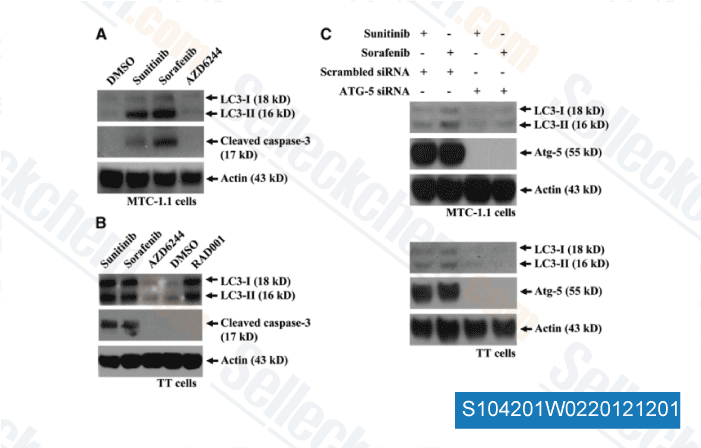
-
Daten von [ Surgery , 2012 , 152, 1142-9 ]
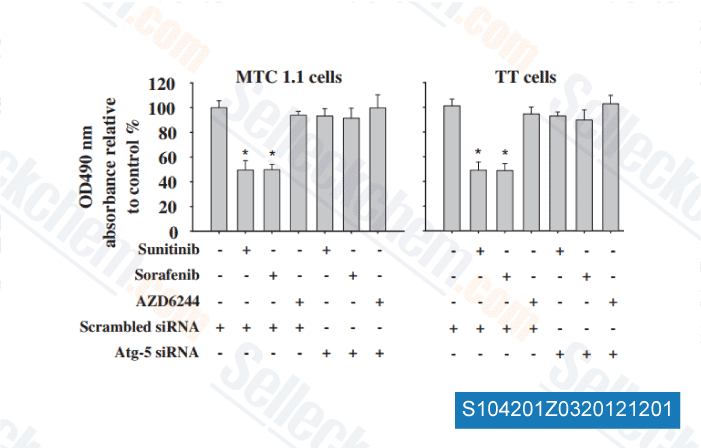
-
Daten von [ Surgery , 2012 , 152, 1142-9 ]
Sellecks Sunitinib (SU11248) Malate Wurde zitiert von 176 Publikationen
| Prolonging lung cancer response to EGFR inhibition by targeting the selective advantage of resistant cells [ Nat Commun, 2025, 16(1):7853] | PubMed: 40846697 |
| Electroacupuncture Prevents Against AD-Like Phenotypes in APP/PS1 Mice: Investigation of the Mechanisms From Cerebral Microangiopathy [ CNS Neurosci Ther, 2025, 31(12):e70696] | PubMed: 41367129 |
| Biofabrication of pheochromocytoma and paraganglioma tumor organoids and assessment of response to systemic therapy [ Sci Rep, 2025, 15(1):35889] | PubMed: 41087622 |
| Overexpression of CSRP1 Suppresses Cell Viability and Enhances the Anti-Cancer Effects of Anti-PD-L1 Therapy in Renal Cell Carcinoma [ Front Biosci (Landmark Ed), 2025, 30(11):46252] | PubMed: 41351404 |
| Establishment, characterization, and biobanking of 36 pancreatic cancer organoids: prediction of metastasis in resectable pancreatic cancer [ Cell Oncol (Dordr), 2024, 10.1007/s13402-024-00939-5] | PubMed: 38619751 |
| Patient-derived rhabdomyosarcoma cells recapitulate the genetic and transcriptomic landscapes of primary tumors [ iScience, 2024, 27(10):110862] | PubMed: 39319271 |
| Canthin-6-One Inhibits Developmental and Tumour-Associated Angiogenesis in Zebrafish [ Pharmaceuticals (Basel), 2024, 17(1)108] | PubMed: 38256941 |
| Impact of sunitinib resistance on clear cell renal cell carcinoma therapeutic sensitivity in vitro [ Cell Cycle, 2024, 1-13.] | PubMed: 38263737 |
| Multi-omics and immunogenomics analysis revealed PFKFB3 as a targetable hallmark and mediates sunitinib resistance in papillary renal cell carcinoma: in silico study with laboratory verification [ Eur J Med Res, 2024, 29(1):236] | PubMed: 38622715 |
| Elucidation and Regulation of Tyrosine Kinase Inhibitor Resistance in Renal Cell Carcinoma Cells from the Perspective of Glutamine Metabolism [ Metabolites, 2024, 14(3)170] | PubMed: 38535330 |
RÜCKGABERICHTLINIE
Die bedingungslose Rückgaberichtlinie von Selleck Chemical gewährleistet unseren Kunden ein reibungsloses Online-Einkaufserlebnis. Wenn Sie in irgendeiner Weise mit Ihrem Kauf unzufrieden sind, können Sie jeden Artikel innerhalb von 7 Tagen nach Erhalt zurückgeben. Im Falle von Produktqualitätsproblemen, sei es protokollbezogene oder produktbezogene Probleme, können Sie jeden Artikel innerhalb von 365 Tagen ab dem ursprünglichen Kaufdatum zurückgeben. Bitte befolgen Sie die nachstehenden Anweisungen, wenn Sie Produkte zurücksenden.
VERSAND UND LAGERUNG
Selleck-Produkte werden bei Raumtemperatur transportiert. Wenn Sie das Produkt bei Raumtemperatur erhalten, seien Sie versichert, dass die Qualitätskontrollabteilung von Selleck Experimente durchgeführt hat, um zu überprüfen, dass die normale Temperaturplatzierung von einem Monat die biologische Aktivität von Pulverprodukten nicht beeinträchtigt. Nach dem Sammeln lagern Sie das Produkt bitte gemäß den in der Datenblatt beschriebenen Anforderungen. Die meisten Selleck-Produkte sind unter den empfohlenen Bedingungen stabil.
NICHT FÜR DIE ANWENDUNG AM MENSCHEN, FÜR VETERINÄRMEDIZINISCHE DIAGNOSTIK ODER THERAPEUTISCHE ZWECKE.
