Technische Daten
| Formel | C23H18ClF2N3O3S |
||||||
| Molekulargewicht | 489.92 | CAS-Nr. | 918504-65-1 | ||||
| Löslichkeit (25°C)* | In vitro | DMSO | 98 mg/mL (200.03 mM) | ||||
| Water | Insoluble | ||||||
| Ethanol | Insoluble | ||||||
| In vivo (Lösungsmittel einzeln und der Reihe nach zum Produkt hinzufügen.) |
|
||||||
|
* <1 mg/ml bedeutet schwer löslich oder unlöslich. * Bitte beachten Sie, dass Selleck die Löslichkeit aller Verbindungen intern testet und die tatsächliche Löslichkeit geringfügig von veröffentlichten Werten abweichen kann. Dies ist normal und ist auf geringfügige Batch-zu-Batch-Variationen zurückzuführen. * Versand bei Raumtemperatur (Stabilitätstests zeigen, dass dieses Produkt ohne Kühlmaßnahmen versendet werden kann.) |
|||||||
Vorbereitung von Stammlösungen
Biologische Aktivität
| Beschreibung | Vemurafenib (PLX4032, RG7204, RO5185426) ist ein neuartiger und potenter Inhibitor von B-RafV600E mit einer IC50 von 31 nM im zellfreien Assay. 10-fach selektiv für B-RafV600E gegenüber Wildtyp-B-Raf in enzymatischen Assays, und die zelluläre Selektivität kann das 100-fache übersteigen. Vemurafenib (PLX4032, RG7204) induziert Autophagy. | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Ziele |
|
|||||||||||
| In vitro | Vemurafenib (PLX4032) hemmt B-RAFV600E, C-RAF sowie Wildtyp-B-RAF mit IC50-Werten von 31 nM, 48 nM bzw. 100 nM. Diese Verbindung hemmt auch mehrere Nicht-RAF-Kinasen, einschließlich ACK1, KHS1 und SRMS, mit IC50-Werten von 18 nM bis 51 nM. In Melanomzelllinien hängt die hemmende Wirkung vom B-RAF-Mutationsstatus ab, da sie B-RAF V600-Mutanten, einschließlich V600E, V600D, V600K und V600R, potent hemmt, jedoch nicht den Wildtyp oder andere Mutanten. Die IC50-Werte auf diesen Zellen, einschließlich MALME-3M, Colo829, Colo38, A375, SK-MEL28 und A2058, reichen von 20 nM bis 1 μM. In diesen Zellen hemmt Vemurafenib (0,1 μM bis 30 μM) auch die Phosphorylierung von MEK1/2 und ERK1/2. Es ist hochwirksam bei der Behandlung von Melanomen, aufgrund seiner Fähigkeit, B-RAFV600E zu hemmen. Diese Verbindung zeigt jedoch eine begrenzte Wirkung bei Darmkrebspatienten, die ebenfalls das B-RAFV600E Onkoprotein tragen. Der Grund dafür ist, dass in Darmkrebszellen die B-RAFV600E-Hemmung durch PLX4032 zu einer schnellen Rückkopplungsaktivierung von EGFR führt, die die PLX4032-gehemmte Zellproliferation kompensiert. | |||||||||||
| In vivo | In B-RAFV600E-mutierten Maus-Xenograftmodellen hemmt Vemurafenib (PLX4032) (6 mg/kg–20 mg/kg) das Tumorwachstum. In Maus-Xenograftmodellen von LOX-, Colo829- und A375-Zellen hemmt diese Verbindung (12,5 mg/kg–100 mg/kg) das Tumorwachstum und verlängert das Überleben der Mäuse. | |||||||||||
| Merkmale | Ein neuartiger und potenter Inhibitor des B-RAFV600E Onkoproteins. |
Protokoll (aus Referenz)
| Kinase-Assay: |
|
|---|---|
| Zell-Assay: |
|
| Tierstudie: |
|
Referenzen
|
Kundenproduktvalidierung
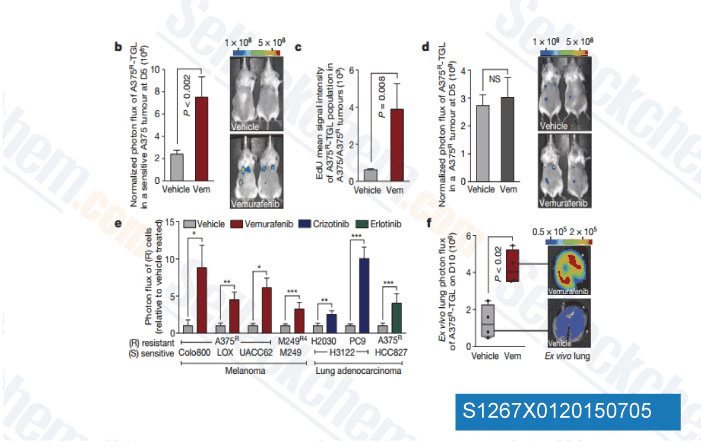
-
Daten von [ Nature , 2015 , 520(7547), 368-72 ]
![FRA1 downregulation during RAFi treatment drives the reactive secretome. c, Relative mRNA levels of FRA1 during vemurafenib exposure [0.1-1 uM]. d, Representative immunofluorescence staining of A375/A375R tumours for GFP (A375R, green) and FRA1 (red) after vehicle or vemurafenib treatment (5 days). DAPI, 49,6-diamidino-2-phenylindole. Scale bars, 50 um.](https://file.selleckchem.com/downloads/review/700px/Vemurafenib-S1267X0220150705.gif)
-
Daten von [ Nature , 2015 , 520(7547), 368-72 ]

-
Daten von [ Oncogene , 2015 , 10.1038/onc.2015.97 ]

-
Daten von [ Nature , 2014 , 508(7494), 118-22 ]
Sellecks PLX4032 (Vemurafenib) Wurde zitiert von 714 Publikationen
| Pan-inhibition of super-enhancer-driven oncogenic transcription by next-generation synthetic ecteinascidins yields potent anti-cancer activity [ Nat Commun, 2025, 16(1):512] | PubMed: 39779693 |
| Blocking interplay between TERT and c-Myc: a new therapeutic strategy for BRAFV600E/pTERT double mutated tumors [ Int J Biol Sci, 2025, 21(11):4961-4978] | PubMed: 40860184 |
| Downregulated ALDH2 Contributes to Tumor Progression and Targeted Therapy Resistance in Human Metastatic Melanoma Cells [ Cells, 2025, 14(12)913] | PubMed: 40558540 |
| Inter-Relationship Between Melanoma Vemurafenib Tolerance Thresholds and Metabolic Pathway Choice [ Cells, 2025, 14(12)923] | PubMed: 40558548 |
| Exploiting Paradoxical Activation of Oncogenic MAPK Signaling by Targeting Mitochondria to Sensitize NRAS Mutant-Melanoma to Vemurafenib [ Int J Mol Sci, 2025, 26(6)2675] | PubMed: 40141318 |
| Acquired resistance to vemurafenib restrains thyroid cancer stem cell self-renewal by suppressing STAT3 activation [ Cell Signal, 2025, 133:111845] | PubMed: 40345509 |
| Dihydrotanshinone I enhanced BRAF mutant melanoma treatment efficacy by inhibiting the STAT3/SOX2 signaling pathway [ Front Oncol, 2025, 15:1429018] | PubMed: 39944829 |
| Suppression of Sebum Production by Vemurafenib Through Paradoxical ERK Activation Resulted in the Inhibition of the mTOR Pathway in 5α-Dihydrotestosterone-Differentiated Hamster Sebocytes In Vitro [ Exp Dermatol, 2025, 34(8):e70150] | PubMed: 40817681 |
| Selective inhibition of p300 by a novel small molecule EPS496 promotes cell death in vemurafenib-resistant BRAFV600E mutated melanoma cells [ Biochem Biophys Res Commun, 2025, 750:151382] | PubMed: 39884005 |
| Increased Mitochondrial Superoxide Level Is Partially Associated With Vemurafenib-Induced Renal Tubular Toxicity [ Basic Clin Pharmacol Toxicol, 2025, 136(4):e70015] | PubMed: 40018909 |
RÜCKGABERICHTLINIE
Die bedingungslose Rückgaberichtlinie von Selleck Chemical gewährleistet unseren Kunden ein reibungsloses Online-Einkaufserlebnis. Wenn Sie in irgendeiner Weise mit Ihrem Kauf unzufrieden sind, können Sie jeden Artikel innerhalb von 7 Tagen nach Erhalt zurückgeben. Im Falle von Produktqualitätsproblemen, sei es protokollbezogene oder produktbezogene Probleme, können Sie jeden Artikel innerhalb von 365 Tagen ab dem ursprünglichen Kaufdatum zurückgeben. Bitte befolgen Sie die nachstehenden Anweisungen, wenn Sie Produkte zurücksenden.
VERSAND UND LAGERUNG
Selleck-Produkte werden bei Raumtemperatur transportiert. Wenn Sie das Produkt bei Raumtemperatur erhalten, seien Sie versichert, dass die Qualitätskontrollabteilung von Selleck Experimente durchgeführt hat, um zu überprüfen, dass die normale Temperaturplatzierung von einem Monat die biologische Aktivität von Pulverprodukten nicht beeinträchtigt. Nach dem Sammeln lagern Sie das Produkt bitte gemäß den in der Datenblatt beschriebenen Anforderungen. Die meisten Selleck-Produkte sind unter den empfohlenen Bedingungen stabil.
NICHT FÜR DIE ANWENDUNG AM MENSCHEN, FÜR VETERINÄRMEDIZINISCHE DIAGNOSTIK ODER THERAPEUTISCHE ZWECKE.
