réservé à la recherche
CC-5013 (Lenalidomide) Immunomodulateur
N° Cat.S1029
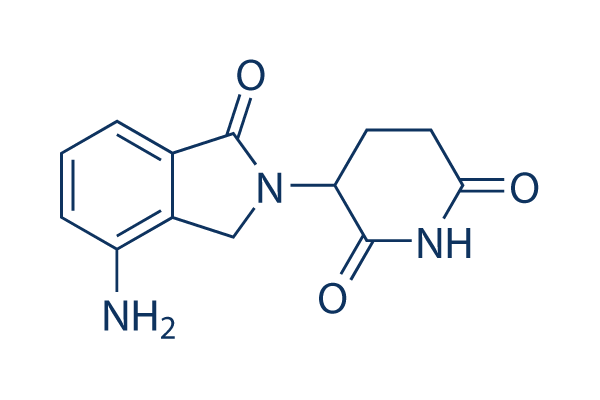
Structure chimique
Poids moléculaire: 259.26
Contrôle qualité
| Cibles apparentées | Proteasome E1 Activating E3 Ligase DUB p97 SUMO E2 conjugating |
|---|---|
| Autre E3 ligase Ligand Inhibiteurs | CC-99282 |
Culture cellulaire, traitement et concentration de travail
| Lignées cellulaires | Type dessai | Concentration | Temps dincubation | Formulation | Description de lactivité | PMID |
|---|---|---|---|---|---|---|
| LB771-HNC | Growth Inhibition Assay | IC50=2.15038 μM | SANGER | |||
| L-363 | Growth Inhibition Assay | IC50=2.92212 μM | SANGER | |||
| JAR | Growth Inhibition Assay | IC50=2.97001 μM | SANGER | |||
| EoL-1-cell | Growth Inhibition Assay | IC50=4.10515 μM | SANGER | |||
| BT-549 | Growth Inhibition Assay | IC50=6.21849 μM | SANGER | |||
| SK-NEP-1 | Growth Inhibition Assay | IC50=7.89512 μM | SANGER | |||
| BV-173 | Growth Inhibition Assay | IC50=8.67585 μM | SANGER | |||
| HMV-II | Growth Inhibition Assay | IC50=10.0172 μM | SANGER | |||
| HCC1806 | Growth Inhibition Assay | IC50=11.4467 μM | SANGER | |||
| KASUMI-1 | Growth Inhibition Assay | IC50=11.571 μM | SANGER | |||
| SK-MEL-28 | Growth Inhibition Assay | IC50=11.9764 μM | SANGER | |||
| RPMI-8226 | Growth Inhibition Assay | IC50=12.6241 μM | SANGER | |||
| T47D | Growth Inhibition Assay | IC50=13.2099 μM | SANGER | |||
| HOP-62 | Growth Inhibition Assay | IC50=13.48 μM | SANGER | |||
| A2058 | Growth Inhibition Assay | IC50=13.8199 μM | SANGER | |||
| SW620 | Growth Inhibition Assay | IC50=14.2473 μM | SANGER | |||
| LCLC-103H | Growth Inhibition Assay | IC50=14.4892 μM | SANGER | |||
| HAL-01 | Growth Inhibition Assay | IC50=14.5796 μM | SANGER | |||
| PANC-08-13 | Growth Inhibition Assay | IC50=14.9108 μM | SANGER | |||
| COLO-684 | Growth Inhibition Assay | IC50=15.3979 μM | SANGER | |||
| DEL | Growth Inhibition Assay | IC50=15.499 μM | SANGER | |||
| K5 | Growth Inhibition Assay | IC50=16.1486 μM | SANGER | |||
| SK-MEL-24 | Growth Inhibition Assay | IC50=16.4652 μM | SANGER | |||
| ACN | Growth Inhibition Assay | IC50=16.5297 μM | SANGER | |||
| H9 | Growth Inhibition Assay | IC50=16.626 μM | SANGER | |||
| EM-2 | Growth Inhibition Assay | IC50=17.143 μM | SANGER | |||
| HSC-4 | Growth Inhibition Assay | IC50=17.6601 μM | SANGER | |||
| IGROV-1 | Growth Inhibition Assay | IC50=17.783 μM | SANGER | |||
| TE-1 | Growth Inhibition Assay | IC50=17.9968 μM | SANGER | |||
| LN-405 | Growth Inhibition Assay | IC50=19.9076 μM | SANGER | |||
| MSTO-211H | Growth Inhibition Assay | IC50=20.3573 μM | SANGER | |||
| MOLT-4 | Growth Inhibition Assay | IC50=20.5759 μM | SANGER | |||
| RS4-11 | Growth Inhibition Assay | IC50=22.1563 μM | SANGER | |||
| ES3 | Growth Inhibition Assay | IC50=22.6963 μM | SANGER | |||
| SBC-1 | Growth Inhibition Assay | IC50=23.8696 μM | SANGER | |||
| CTV-1 | Growth Inhibition Assay | IC50=25.0149 μM | SANGER | |||
| HuP-T3 | Growth Inhibition Assay | IC50=25.4009 μM | SANGER | |||
| HCC2218 | Growth Inhibition Assay | IC50=25.5407 μM | SANGER | |||
| HDLM-2 | Growth Inhibition Assay | IC50=28.2026 μM | SANGER | |||
| ABC-1 | Growth Inhibition Assay | IC50=29.6974 μM | SANGER | |||
| MV-4-11 | Growth Inhibition Assay | IC50=29.7317 μM | SANGER | |||
| WM-115 | Growth Inhibition Assay | IC50=30.3099 μM | SANGER | |||
| SW1990 | Growth Inhibition Assay | IC50=30.33 μM | SANGER | |||
| HCC70 | Growth Inhibition Assay | IC50=30.7346 μM | SANGER | |||
| KYSE-520 | Growth Inhibition Assay | IC50=30.8839 μM | SANGER | |||
| JEG-3 | Growth Inhibition Assay | IC50=31.1614 μM | SANGER | |||
| C8166 | Growth Inhibition Assay | IC50=31.2274 μM | SANGER | |||
| SK-OV-3 | Growth Inhibition Assay | IC50=31.6755 μM | SANGER | |||
| NCI-H526 | Growth Inhibition Assay | IC50=32.683 μM | SANGER | |||
| NKM-1 | Growth Inhibition Assay | IC50=32.9568 μM | SANGER | |||
| ECC10 | Growth Inhibition Assay | IC50=34.7443 μM | SANGER | |||
| A2780 | Growth Inhibition Assay | IC50=35.3601 μM | SANGER | |||
| KY821 | Growth Inhibition Assay | IC50=35.7681 μM | SANGER | |||
| MKN1 | Growth Inhibition Assay | IC50=36.2137 μM | SANGER | |||
| EKVX | Growth Inhibition Assay | IC50=37.4212 μM | SANGER | |||
| EW-16 | Growth Inhibition Assay | IC50=38.3885 μM | SANGER | |||
| CTB-1 | Growth Inhibition Assay | IC50=39.7789 μM | SANGER | |||
| COR-L105 | Growth Inhibition Assay | IC50=40.4746 μM | SANGER | |||
| NCI-SNU-5 | Growth Inhibition Assay | IC50=41.2069 μM | SANGER | |||
| Mewo | Growth Inhibition Assay | IC50=41.9871 μM | SANGER | |||
| BCPAP | Growth Inhibition Assay | IC50=43.7917 μM | SANGER | |||
| KARPAS-45 | Growth Inhibition Assay | IC50=44.2776 μM | SANGER | |||
| NCI-H1693 | Growth Inhibition Assay | IC50=46.6986 μM | SANGER | |||
| H-EMC-SS | Growth Inhibition Assay | IC50=48.3224 μM | SANGER | |||
| 697 | Growth Inhibition Assay | IC50=50.3545 μM | SANGER | |||
| KP-N-YS | Growth Inhibition Assay | IC50=52.3142 μM | SANGER | |||
| NCI-H1304 | Growth Inhibition Assay | IC50=52.7024 μM | SANGER | |||
| NOS-1 | Growth Inhibition Assay | IC50=52.8559 μM | SANGER | |||
| NCI-H2342 | Growth Inhibition Assay | IC50=53.0508 μM | SANGER | |||
| KYSE-270 | Growth Inhibition Assay | IC50=53.6364 μM | SANGER | |||
| LU-135 | Growth Inhibition Assay | IC50=55.1853 μM | SANGER | |||
| OE33 | Growth Inhibition Assay | IC50=55.818 μM | SANGER | |||
| ML-2 | Growth Inhibition Assay | IC50=55.9489 μM | SANGER | |||
| KMOE-2 | Growth Inhibition Assay | IC50=56.2893 μM | SANGER | |||
| Daoy | Growth Inhibition Assay | IC50=56.3204 μM | SANGER | |||
| KNS-62 | Growth Inhibition Assay | IC50=57.0142 μM | SANGER | |||
| NBsusSR | Growth Inhibition Assay | IC50=57.5705 μM | SANGER | |||
| UACC-257 | Growth Inhibition Assay | IC50=58.6264 μM | SANGER | |||
| LU-139 | Growth Inhibition Assay | IC50=58.826 μM | SANGER | |||
| CAL-85-1 | Growth Inhibition Assay | IC50=58.8643 μM | SANGER | |||
| NCI-H720 | Growth Inhibition Assay | IC50=58.8942 μM | SANGER | |||
| MLMA | Growth Inhibition Assay | IC50=59.091 μM | SANGER | |||
| A3-KAW | Growth Inhibition Assay | IC50=59.2809 μM | SANGER | |||
| Ramos-2G6-4C10 | Growth Inhibition Assay | IC50=59.6287 μM | SANGER | |||
| A388 | Growth Inhibition Assay | IC50=60.449 μM | SANGER | |||
| LAMA-84 | Growth Inhibition Assay | IC50=60.9905 μM | SANGER | |||
| GCT | Growth Inhibition Assay | IC50=61.0786 μM | SANGER | |||
| K-562 | Growth Inhibition Assay | IC50=61.5333 μM | SANGER | |||
| NCI-H1666 | Growth Inhibition Assay | IC50=61.875 μM | SANGER | |||
| NCI-H1993 | Growth Inhibition Assay | IC50=63.4043 μM | SANGER | |||
| NCI-H358 | Growth Inhibition Assay | IC50=65.0121 μM | SANGER | |||
| NB6 | Growth Inhibition Assay | IC50=65.988 μM | SANGER | |||
| HCE-T | Growth Inhibition Assay | IC50=67.0798 μM | SANGER | |||
| DOK | Growth Inhibition Assay | IC50=67.4948 μM | SANGER | |||
| HT-1376 | Growth Inhibition Assay | IC50=69.8314 μM | SANGER | |||
| NEC8 | Growth Inhibition Assay | IC50=70.1243 μM | SANGER | |||
| G-402 | Growth Inhibition Assay | IC50=70.9395 μM | SANGER | |||
| GR-ST | Growth Inhibition Assay | IC50=71.172 μM | SANGER | |||
| QIMR-WIL | Growth Inhibition Assay | IC50=71.4434 μM | SANGER | |||
| CHP-212 | Growth Inhibition Assay | IC50=71.965 μM | SANGER | |||
| KU812 | Growth Inhibition Assay | IC50=72.9702 μM | SANGER | |||
| Becker | Growth Inhibition Assay | IC50=73.1489 μM | SANGER | |||
| ChaGo-K-1 | Growth Inhibition Assay | IC50=74.7486 μM | SANGER | |||
| A498 | Growth Inhibition Assay | IC50=74.9308 μM | SANGER | |||
| NCI-H69 | Growth Inhibition Assay | IC50=75.7663 μM | SANGER | |||
| NCI-H209 | Growth Inhibition Assay | IC50=78.6147 μM | SANGER | |||
| CAL-33 | Growth Inhibition Assay | IC50=78.9939 μM | SANGER | |||
| COLO-680N | Growth Inhibition Assay | IC50=79.1007 μM | SANGER | |||
| D-283MED | Growth Inhibition Assay | IC50=79.812 μM | SANGER | |||
| ATN-1 | Growth Inhibition Assay | IC50=81.1187 μM | SANGER | |||
| NCI-N87 | Growth Inhibition Assay | IC50=81.7296 μM | SANGER | |||
| MHH-NB-11 | Growth Inhibition Assay | IC50=81.8849 μM | SANGER | |||
| HEL | Growth Inhibition Assay | IC50=82.4134 μM | SANGER | |||
| NB69 | Growth Inhibition Assay | IC50=83.0033 μM | SANGER | |||
| MPP-89 | Growth Inhibition Assay | IC50=83.2575 μM | SANGER | |||
| COLO-829 | Growth Inhibition Assay | IC50=85.4912 μM | SANGER | |||
| ONS-76 | Growth Inhibition Assay | IC50=85.7908 μM | SANGER | |||
| EW-3 | Growth Inhibition Assay | IC50=86.2032 μM | SANGER | |||
| EW-11 | Growth Inhibition Assay | IC50=86.4336 μM | SANGER | |||
| SW900 | Growth Inhibition Assay | IC50=87.2053 μM | SANGER | |||
| MOLT-13 | Growth Inhibition Assay | IC50=87.2243 μM | SANGER | |||
| HuP-T4 | Growth Inhibition Assay | IC50=91.0405 μM | SANGER | |||
| HCC1419 | Growth Inhibition Assay | IC50=91.6374 μM | SANGER | |||
| CAL-72 | Growth Inhibition Assay | IC50=92.0219 μM | SANGER | |||
| Mo-T | Growth Inhibition Assay | IC50=92.7697 μM | SANGER | |||
| OC-314 | Growth Inhibition Assay | IC50=92.8821 μM | SANGER | |||
| BHT-101 | Growth Inhibition Assay | IC50=93.1 μM | SANGER | |||
| EW-18 | Growth Inhibition Assay | IC50=93.8462 μM | SANGER | |||
| TE-12 | Growth Inhibition Assay | IC50=94.3055 μM | SANGER | |||
| MDA-MB-361 | Growth Inhibition Assay | IC50=96.0516 μM | SANGER | |||
| DF15 | Function assay | 4 hrs | Induction of CRL4/CRBN ubiquitin ligase-mediated aiolos degradation in human DF15 cells expressing pLOC-ePL-tagged aiolos after 4 hrs by luminescence based beta-galactosidase enzyme fragmentation complementation assay, EC50 = 0.053 μM. | 28358507 | ||
| DF15 | Function assay | 4 hrs | Induction of cereblon-mediated ikaros degradation in human DF15 cells expressing ePL-tagged ikaros after 4 hrs by luminometric analysis, EC50 = 0.067 μM. | 28425720 | ||
| DF15 | Function assay | 4 hrs | Induction of cereblon-mediated aiolos degradation in human DF15 cells expressing ePL-tagged aiolos after 4 hrs by luminometric analysis, EC50 = 0.087 μM. | 28425720 | ||
| T-cells | Function assay | 2 to 3 days | Inhibition of IL-2 production in human T cells measured after 2 to 3 days by ELISA, EC50 = 0.15 μM. | 23168019 | ||
| NAMALWA | Antiproliferative assay | 72 hrs | Antiproliferative activity against human NAMALWA cells assessed as inhibition of [3H]thymidine incorporation after 72 hrs by scintillation counting, IC50 = 0.36 μM. | 23168019 | ||
| CD34+ progenitor cells | Function assay | 14 days | Decrease in erythroid differentiation of CD34+ progenitor cells from myelodysplastic syndrome del(5q) patient assessed as CD36 expression after 14 days | 17576924 | ||
| CD34+ progenitor cells | Function assay | 14 days | Decrease in myeloid differentiation of CD34+ progenitor cells from myelodysplastic syndrome del(5q) patient assessed as CD33 expression after 14 days | 17576924 | ||
| CD34+ progenitor cells | Function assay | 14 days | Decrease in erythroid differentiation of CD34+ progenitor cells from myelodysplastic syndrome del(5q) patient assessed as glycophorin A expression after 14 days | 17576924 | ||
| CD34+ progenitor cells | Growth inhibition assay | 14 days | Inhibition of cell proliferation of CD34+ progenitor cells from myelodysplastic syndrome del(5q) patient after 14 days | 17576924 | ||
| CD34+ progenitor cells | Growth inhibition assay | 14 days | Growth inhibition of CD34+ progenitor cells from non-del(5q) myelodysplastic syndrome patient after 14 days | 17576924 | ||
| DF15 | Function assay | 0.1 to 10 uM | 5 hrs | Induction of cereblon-mediated aiolos degradation in human DF15 cells at 0.1 to 10 uM after 5 hrs by immunoblot analysis | 28425720 | |
| OPM2 | Function assay | 0.1 to 10 uM | 5 hrs | Induction of cereblon-mediated aiolos degradation in human OPM2 cells at 0.1 to 10 uM after 5 hrs by immunoblot analysis | 28425720 | |
| DF15 | Function assay | 0.1 to 10 uM | 5 hrs | Induction of cereblon-mediated ikaros degradation in human DF15 cells at 0.1 to 10 uM after 5 hrs by immunoblot analysis | 28425720 | |
| OPM2 | Function assay | 0.1 to 10 uM | 5 hrs | Induction of cereblon-mediated ikaros degradation in human OPM2 cells at 0.1 to 10 uM after 5 hrs by immunoblot analysis | 28425720 | |
| EC9706 | Antiproliferative assay | 150 ug/mL | 48 hrs | Antiproliferative activity against human EC9706 cells at 150 ug/mL after 48 hrs by CCK-8 assay | 28757066 | |
| Cliquez pour voir plus de données expérimentales sur les lignées cellulaires | ||||||
Informations chimiques, stockage et stabilité
| Poids moléculaire | 259.26 | Formule | C13H13N3O3 |
Stockage (À partir de la date de réception) | |
|---|---|---|---|---|---|
| N° CAS | 191732-72-6 | Télécharger le SDF | Stockage des solutions mères |
|
|
| Synonymes | CC-5013 | Smiles | C1CC(=O)NC(=O)C1N2CC3=C(C2=O)C=CC=C3N | ||
Solubilité
|
In vitro |
DMSO
: 51 mg/mL
(196.71 mM)
Water : Insoluble Ethanol : Insoluble |
Calculateur de molarité
|
In vivo |
|||||
Calculateur de formulation in vivo (Solution claire)
Étape 1 : Entrez les informations ci-dessous (Recommandé : Un animal supplémentaire pour tenir compte des pertes pendant lexpérience)
Étape 2 : Entrez la formulation in vivo (Ceci nest que le calculateur, pas la formulation. Veuillez nous contacter dabord sil ny a pas de formulation in vivo dans la section Solubilité.)
Résultats du calcul :
Concentration de travail : mg/ml;
Méthode de préparation du liquide maître DMSO : mg médicament prédissous dans μL DMSO ( Concentration du liquide maître mg/mL, Veuillez nous contacter dabord si la concentration dépasse la solubilité du DMSO du lot de médicament. )
Méthode de préparation de la formulation in vivo : Prendre μL DMSO liquide maître, ajouter ensuiteμL PEG300, mélanger et clarifier, ajouter ensuiteμL Tween 80, mélanger et clarifier, ajouter ensuite μL ddH2O, mélanger et clarifier.
Méthode de préparation de la formulation in vivo : Prendre μL DMSO liquide maître, ajouter ensuite μL Huile de maïs, mélanger et clarifier.
Remarque : 1. Assurez-vous que le liquide est clair avant dajouter le solvant suivant.
2. Assurez-vous dajouter le(s) solvant(s) dans lordre. Vous devez vous assurer que la solution obtenue lors de lajout précédent est une solution claire avant de procéder à lajout du solvant suivant. Des méthodes physiques telles que le vortex, les ultrasons ou le bain-marie peuvent être utilisées pour faciliter la dissolution.
Mécanisme daction
| Targets/IC50/Ki |
CRBN
VEGF
TNF-α
(PBMCs) 13 nM
|
|---|---|
| In vitro |
Le lénalidomide induit fortement la production d'IL-2 et de sIL-2R. Cette phosphorylation de la tyrosine de CD28 sur les lymphocytes T, induite par le composé, est suivie d'une activation en aval de NF-κB. Ce composé et le pomalidomide inhibent l'autoubiquitination de CRBN dans les cellules HEK293 T exprimant le CRBN de type sauvage compétent pour la liaison à la thalidomide, mais pas le CRBN(YW/AA) défectueux pour la liaison à la thalidomide. La surexpression de la protéine CRBN de type sauvage, mais pas de la protéine mutante CRBN(YW/AA), dans les cellules de myélome KMS12, amplifie les réductions médiées par le pomalidomide dans l'expression de c-myc et d'IRF4 et les augmentations de l'expression de p21(WAF-1). La sélection à long terme pour la résistance à ce composé dans les lignées cellulaires de myélome H929 s'accompagne d'une réduction de CRBN, tandis que dans les cellules de myélome DF15R résistantes à la fois au pomalidomide et à ce produit chimique, la protéine CRBN est indétectable. Ce produit chimique prévient l'induction de défauts en régulant à la baisse l'expression des molécules inhibitrices des cellules tumorales. Il prévient l'induction d'un dysfonctionnement de la synapse lytique des lymphocytes T induit par la tumeur. Ce traitement composé bloque le dysfonctionnement de la synapse d'actine des lymphocytes T induit par les cellules CLL, imite le blocage des anticorps et régule à la baisse l'expression des ligands inhibiteurs des CLL et de leurs récepteurs sur les lymphocytes T. Ce traitement prévient l'immunosuppression induite par la tumeur dans le FL, le DLBCL, le HL, le MM, le SCC et l'OC et régule à la baisse l'expression des ligands immunosuppresseurs sur toutes les cellules tumorales examinées. La fonction de destruction des CTL augmente de manière significative après le blocage des anticorps des ligands inhibiteurs des CLL ou ce traitement chimique par rapport aux traitements de contrôle. Le traitement des cocultures autologues de lymphocytes T-CLL avec cet agent inverse la formation altérée de la synapse lytique des lymphocytes T CD8+ et le trafic de granzyme B. |
| Kinase Assay |
Dosage de l'inhibition de la synthèse de TNF par les PBMC humains
|
|
Les PBMC humains de donneurs normaux sont obtenus par centrifugation de densité sur Ficoll-Hypaque. Les cellules (106 cellules/mL) sont cultivées dans du RPMI supplémenté avec 10 sérum AB+, 2 mM de L-glutamine, 100 U/mL de pénicilline et 100 μg/mL de streptomycine. Le lénalidomide est dissous dans du DMSO à 20 mg/mL; une dilution supplémentaire est effectuée avec le milieu de culture. La concentration finale de DMSO dans tous les essais, y compris les contrôles, est de 0,25%. Ce composé est ajouté aux cellules 1 heure avant l'ajout de LPS. Les PBMC (106 cellules/mL) sont stimulées avec 1 μg/mL de LPS de Salmonella minnesota R595. Les cellules, en triple, sont incubées avec du LPS pendant 18-20 heures à 37 °C dans 5% de CO2. Les surnageants sont ensuite récoltés et dosés pour les niveaux de cytokines. Dans certaines expériences, les surnageants sont conservés congelés à -70 °C jusqu'à utilisation. La viabilité cellulaire est déterminée par la méthode d'exclusion du colorant bleu Trypan. La concentration de TNFα dans les surnageants de culture est déterminée par ELISA. Ce produit chimique est dosé dans un minimum de trois expériences distinctes. Le pourcentage d'inhibition est déterminé comme 100 × [1 - (cytokine(expérimental)/cytokine(contrôle))].
|
|
| In vivo |
L'induction de l'angiogenèse par le bFGF est significativement inhibée par un traitement oral de Lénalidomide de manière dose-dépendante. Ce composé diminue significativement le pourcentage de zone vascularisée de 5,16% (groupe contrôle) à 2,58% (50 mg/kg). Il réduit significativement le MVL total calculé de 21,07 (contrôle) à 8,11 (50 mg/kg). Ce produit chimique inhibe significativement la migration des HUVEC à travers les membranes revêtues de fibronectine vers 0,1 ng/mL de bFGF à 100 μM, 1 ng/mL de VEGF à des concentrations de 10 μM et 100 μM. |
Références |
|
Applications
| Méthodes | Biomarqueurs | Images | PMID |
|---|---|---|---|
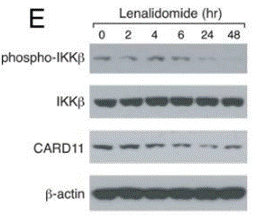
| Western blot | phospho-IKKβ / IKKβ MDM2 / p-MDM2 / p-p53 / p53 |
|
22698399 |
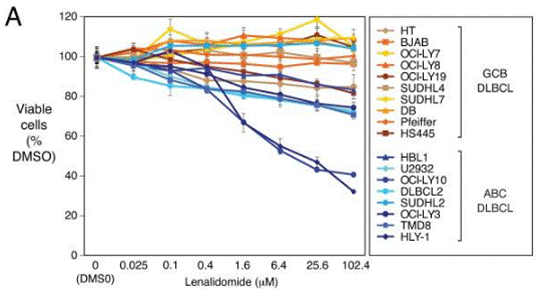
| Growth inhibition assay | Cell viability |
|
22698399 |
Informations sur lessai clinique
(données de https://clinicaltrials.gov, mis à jour le 2024-05-22)
| Numéro NCT | Recrutement | Conditions | Sponsor/Collaborateurs | Date de début | Phases |
|---|---|---|---|---|---|
| NCT06177028 | Not yet recruiting | Cognitive Impairment Mild|Cognitive Dysfunction|Amyloid Plaque|Neurodegenerative Disease Hereditary|Inflammation Brain |
St. Joseph''s Hospital and Medical Center Phoenix|Texas Tech University |
January 2 2024 | Phase 2 |
| NCT06149286 | Recruiting | Relapsed/Refractory Follicular Lymphoma|Marginal Zone Lymphoma (MZL) |
Regeneron Pharmaceuticals |
December 28 2023 | Phase 3 |
| NCT06299553 | Recruiting | DLBCL - Diffuse Large B Cell Lymphoma |
Incyte Biosciences Italy S.r.l |
December 4 2023 | -- |
Support technique
Tel: +1-832-582-8158 Ext:3
Si vous avez dautres questions, veuillez laisser un message.
Questions fréquemment posées
Question 1:
What is the formulation for its injection (i.p.) in mice?
Réponse :
This paper has the information you need: http://link.springer.com/article/10.1208/s12248-012-9401-2. Add it to the appropriate volume of sterile phosphate-buffered saline (PBS) containing 1% hydrochloric acid (HCl). The pH of this preparation was adjusted to 7.0–7.6 using sodium hydroxide and sterile filtered using a 0.22 μm Steriflip filter.
Question 2:
what is the procedure to resuspend it?
Réponse :
This compound can be resuspended by DMSO, with a solubility of about 52 mg/mL (200.57 mM). For in vivo study, the working solution can be prepared with the vehicle of: 30% PEG400/0.5% Tween80/5% propylene glycol for oral administration.
