réservé à la recherche
Nile Red Dyes inhibiteur
N° Cat.S6818
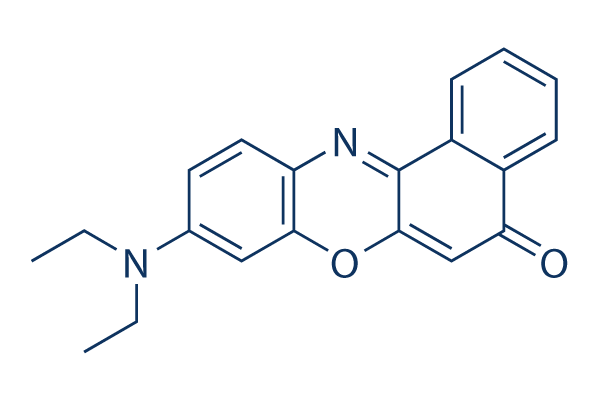
Structure chimique
Poids moléculaire: 318.37
Contrôle qualité
- Cité dans Nature Medicine pour sa qualité supérieure
- COA
- HPLC
- SDS
- Fiche technique
Informations chimiques, stockage et stabilité
| Poids moléculaire | 318.37 | Formule | C20H18N2O2 |
Stockage (À partir de la date de réception) | 3 years -20°C(in the dark) powder |
|---|---|---|---|---|---|
| N° CAS | 7385-67-3 | -- | Stockage des solutions mères |
|
|
| Synonymes | Nile Blue A oxazone, Phenoxazone 9 | Smiles | CCN(CC)C1=CC2=C(C=C1)N=C3C4=CC=CC=C4C(=O)C=C3O2 | ||
Solubilité
|
In vitro |
DMSO
: 40 mg/mL
(125.63 mM)
Water : Insoluble Ethanol : Insoluble |
Calculateur de molarité
|
In vivo |
|||||
Calculateur de formulation in vivo (Solution claire)
Étape 1 : Entrez les informations ci-dessous (Recommandé : Un animal supplémentaire pour tenir compte des pertes pendant lexpérience)
Étape 2 : Entrez la formulation in vivo (Ceci nest que le calculateur, pas la formulation. Veuillez nous contacter dabord sil ny a pas de formulation in vivo dans la section Solubilité.)
Résultats du calcul :
Concentration de travail : mg/ml;
Méthode de préparation du liquide maître DMSO : mg médicament prédissous dans μL DMSO ( Concentration du liquide maître mg/mL, Veuillez nous contacter dabord si la concentration dépasse la solubilité du DMSO du lot de médicament. )
Méthode de préparation de la formulation in vivo : Prendre μL DMSO liquide maître, ajouter ensuiteμL PEG300, mélanger et clarifier, ajouter ensuiteμL Tween 80, mélanger et clarifier, ajouter ensuite μL ddH2O, mélanger et clarifier.
Méthode de préparation de la formulation in vivo : Prendre μL DMSO liquide maître, ajouter ensuite μL Huile de maïs, mélanger et clarifier.
Remarque : 1. Assurez-vous que le liquide est clair avant dajouter le solvant suivant.
2. Assurez-vous dajouter le(s) solvant(s) dans lordre. Vous devez vous assurer que la solution obtenue lors de lajout précédent est une solution claire avant de procéder à lajout du solvant suivant. Des méthodes physiques telles que le vortex, les ultrasons ou le bain-marie peuvent être utilisées pour faciliter la dissolution.
Mécanisme daction
| Targets/IC50/Ki |
lipid droplet
|
|---|---|
| In vitro |
1. Préparation de la solution de travail Phalloidin-TRITC |
Références |
Support technique
Tel: +1-832-582-8158 Ext:3
Si vous avez dautres questions, veuillez laisser un message.
