réservé à la recherche
AC480 (BMS-599626) HER2 inhibiteur
N° Cat.S1056
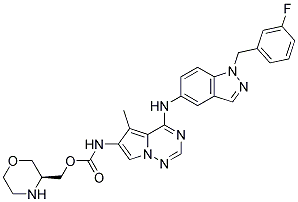
Structure chimique
Poids moléculaire: 530.55
Contrôle qualité
| Cibles apparentées | EGFR VEGFR PDGFR FGFR c-Met Src MEK CSF-1R FLT3 c-Kit |
|---|---|
| Autre HER2 Inhibiteurs | CP-724714 Sapitinib (AZD8931) Mubritinib (TAK 165) Tyrphostin AG 879 HER2-Inhibitor-1 TAS0728 Zongertinib |
Informations chimiques, stockage et stabilité
| Poids moléculaire | 530.55 | Formule | C27H27FN8O3 |
Stockage (À partir de la date de réception) | |
|---|---|---|---|---|---|
| N° CAS | 714971-09-2 | Télécharger le SDF | Stockage des solutions mères |
|
|
| Synonymes | N/A | Smiles | CC1=C2C(=NC=NN2C=C1NC(=O)OCC3COCCN3)NC4=CC5=C(C=C4)N(N=C5)CC6=CC(=CC=C6)F | ||
Solubilité
|
In vitro |
DMSO
: 113 mg/mL
(212.98 mM)
Ethanol : 20 mg/mL Water : Insoluble |
Calculateur de molarité
|
In vivo |
|||||
Calculateur de formulation in vivo (Solution claire)
Étape 1 : Entrez les informations ci-dessous (Recommandé : Un animal supplémentaire pour tenir compte des pertes pendant lexpérience)
Étape 2 : Entrez la formulation in vivo (Ceci nest que le calculateur, pas la formulation. Veuillez nous contacter dabord sil ny a pas de formulation in vivo dans la section Solubilité.)
Résultats du calcul :
Concentration de travail : mg/ml;
Méthode de préparation du liquide maître DMSO : mg médicament prédissous dans μL DMSO ( Concentration du liquide maître mg/mL, Veuillez nous contacter dabord si la concentration dépasse la solubilité du DMSO du lot de médicament. )
Méthode de préparation de la formulation in vivo : Prendre μL DMSO liquide maître, ajouter ensuiteμL PEG300, mélanger et clarifier, ajouter ensuiteμL Tween 80, mélanger et clarifier, ajouter ensuite μL ddH2O, mélanger et clarifier.
Méthode de préparation de la formulation in vivo : Prendre μL DMSO liquide maître, ajouter ensuite μL Huile de maïs, mélanger et clarifier.
Remarque : 1. Assurez-vous que le liquide est clair avant dajouter le solvant suivant.
2. Assurez-vous dajouter le(s) solvant(s) dans lordre. Vous devez vous assurer que la solution obtenue lors de lajout précédent est une solution claire avant de procéder à lajout du solvant suivant. Des méthodes physiques telles que le vortex, les ultrasons ou le bain-marie peuvent être utilisées pour faciliter la dissolution.
Mécanisme daction
| Targets/IC50/Ki |
HER1
20 nM
HER2
30 nM
HER4
190 nM
|
|---|---|
| In vitro |
AC480 (BMS-599626) est identifié comme un inhibiteur compétitif de l'ATP pour HER1 et comme un inhibiteur non compétitif de l'ATP pour HER2 avec des Ki de 2 nM et 5 nM, respectivement. Il inhibe également le récepteur apparenté HER4, mais avec une puissance réduite avec une IC50 de 190 nM. Ce composé inhibe la prolifération des cellules tumorales exprimant des niveaux élevés de HER1 et/ou HER2, y compris les cellules Sal2, BT474, N87, KPL-4, HCC202, HCC1954, HCC1419, AU565, ZR-75-30, MDA-MB-175, GEO et PC9 avec des IC50 de 0,24 μM, 0,31 μM, 0,45 μM, 0,38 μM, 0,94 μM, 0,34 μM, 0,75 μM, 0,63 μM, 0,51 μM, 0,84 μM, 0,90 μM et 0,34 μM, respectivement. Tandis que la prolifération de la lignée cellulaire tumorale ovarienne A2780 et des fibroblastes MRC5, qui n'expriment ni HER1 ni HER2, n'est pas significativement inhibée par celui-ci. Une étude récente montre qu'il améliore significativement la radiosensibilité des cellules HN-5 exprimant à la fois l'EGFR et HER2, en favorisant la redistribution du cycle et en inhibant la réparation de l'ADN.
|
| Kinase Assay |
Essais de Protein Tyrosine Kinase
|
|
Les séquences cytoplasmiques complètes de HER1, HER2 et HER4 sont exprimées sous forme de protéines recombinantes dans des cellules d'insectes Sf9. HER1 et HER4 sont exprimées sous forme de protéines de fusion avec la glutathion-S-transférase et sont purifiées par chromatographie d'affinité sur glutathion-S-Sépharose. HER2 est sous-clonée dans le vecteur pBlueBac4 et exprimée sous forme de protéine non marquée en utilisant un codon méthionine interne (M687) pour l'initiation de la traduction. La protéine HER2 tronquée est isolée par chromatographie sur une colonne de DEAE-Sépharose équilibrée dans un tampon contenant 0,1 M de NaCl, et la protéine recombinante est éluée avec un tampon contenant 0,3 M de NaCl. Pour les essais de kinase HER, les volumes de réaction sont de 50 μL et contiennent 10 ng de protéine de fusion glutathion-S-transférase ou 150 ng de HER2 partiellement purifiée. Les mélanges contiennent également 1,5 μM de poly(Glu/Tyr) (4:1), 1 μM d'ATP, 0,15 μCi de [γ-33P]ATP, 50 mM de Tris-HCl (pH 7,7), 2 mM de DTT, 0,1 mg/mL d'albumine de sérum bovin et 10 mM de MnCl2. Les réactions sont laissées à 27°C pendant 1 heure et sont terminées par l'ajout de 10 μL d'un tampon d'arrêt (2,5 mg/mL d'albumine de sérum bovin et 0,3 M d'EDTA), suivi d'un mélange de 108 μL de 3,5 mM d'ATP et 5% d'acide trichloroacétique. Les protéines insolubles dans l'acide sont récupérées sur des plaques GF/C Unifilter avec un moissonneur Filtermate. L'incorporation du phosphate radioactif dans le substrat poly(Glu/Tyr) est déterminée par comptage par scintillation liquide. Le pourcentage d'inhibition de l'activité kinase est déterminé par des analyses de régression non linéaire et les données sont rapportées comme la concentration inhibitrice requise pour atteindre 50% d'inhibition par rapport aux réactions de contrôle (IC50). Les données sont les moyennes de déterminations en triple. Toutes les autres Protein Tyrosine Kinase sont également testées en utilisant du poly(Glu/Tyr) comme substrat. La cinétique de l'inhibition de HER1 et HER2 est déterminée dans des mélanges de réaction contenant des concentrations variables d'ATP et d'AC480 (BMS-599626).
|
|
| In vivo |
AC480 (BMS-599626) produit une puissante activité antitumorale dans un xénogreffe de tumeur mammaire humaine KPL-4 à sa dose maximale tolérée de 180 mg/kg, et présente également une activité antitumorale similaire dans d'autres modèles de xénogreffes amplifiées pour HER2, ainsi que dans d'autres modèles de xénogreffes surexprimant HER1. In vivo, l'administration orale de ce composé entraîne une inhibition dose-dépendante de la croissance tumorale de Sal2 à des doses allant de 60 mg/kg à 240 mg/kg.
|
Références |
|
Informations sur lessai clinique
(données de https://clinicaltrials.gov, mis à jour le 2024-05-22)
| Numéro NCT | Recrutement | Conditions | Sponsor/Collaborateurs | Date de début | Phases |
|---|---|---|---|---|---|
| NCT01245543 | Withdrawn | Solid Tumors |
Daiichi Sankyo |
November 2010 | Phase 1 |
| NCT00979173 | Completed | Glioma |
Annick Desjardins|Ambit Biosciences Corporation|Duke University |
November 2009 | Phase 1 |
| NCT00093730 | Completed | Unspecified Adult Solid Tumor Protocol Specific |
Jonsson Comprehensive Cancer Center|National Cancer Institute (NCI) |
August 2004 | Phase 1 |
| NCT00095537 | Completed | Cancer|Metastases |
Bristol-Myers Squibb |
March 2004 | Phase 1 |
Support technique
Tel: +1-832-582-8158 Ext:3
Si vous avez dautres questions, veuillez laisser un message.
