uitsluitend voor onderzoeksdoeleinden
KW-2449 FLT3 remmer
Cat.Nr.S2158
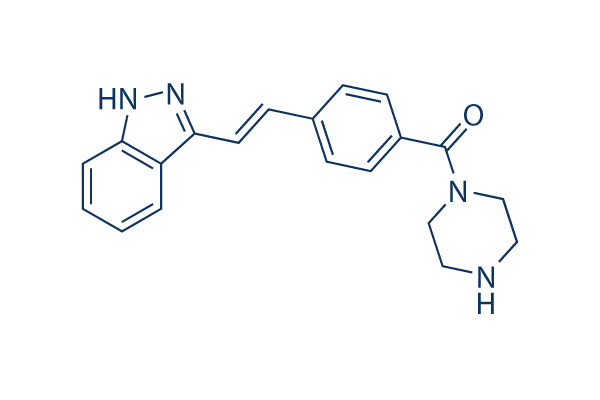
Chemische structuur
Moleculair gewicht: 332.4
Kwaliteitscontrole
| Gerelateerde doelwitten | EGFR VEGFR JAK PDGFR FGFR Src HIF FLT HER2 Bcr-Abl |
|---|---|
| Overige FLT3 Inhibitoren | UNC2025 Crenolanib (CP-868596) Dovitinib (TKI-258) Dovitinib (TKI258) Lactate monohydrate Tandutinib (MLN518) ENMD-2076 AST-487 (NVP-AST487) TCS 359 G-749 AMG 925 |
Chemische informatie, Opslag en Stabiliteit
| Moleculair gewicht | 332.4 | Formule | C20H20N4O |
Opslag (Vanaf de ontvangstdatum) | |
|---|---|---|---|---|---|
| CAS-nr. | 1000669-72-6 | SDF downloaden | Opslag van stamoplossingen |
|
|
| Synoniemen | N/A | Smiles | C1CN(CCN1)C(=O)C2=CC=C(C=C2)C=CC3=NNC4=CC=CC=C43 | ||
Oplosbaarheid
|
In vitro |
DMSO
: 67 mg/mL
(201.56 mM)
Ethanol : 67 mg/mL Water : Insoluble |
Molariteitscalculator
|
In vivo |
|||||
In vivo Formuleringscalculator (Heldere oplossing)
Stap 1: Voer de onderstaande informatie in (Aanbevolen: Een extra dier voor het geval van verlies tijdens het experiment)
Stap 2: Voer de in vivo formulering in (Dit is alleen de calculator, geen formulering. Neem eerst contact met ons op als er geen in vivo formulering is in het gedeelte Oplosbaarheid.)
Berekeningsresultaten:
Werkconcentratie: mg/ml;
Methode voor het bereiden van DMSO-mastervloeistof: mg geneesmiddel vooraf opgelost in μL DMSO ( Concentratie mastervloeistof mg/mL, Neem eerst contact met ons op als de concentratie de DMSO-oplosbaarheid van de partij geneesmiddel overschrijdt. )
Methode voor het bereiden van in vivo formulering: Neem μL DMSO mastervloeistof, voeg vervolgens toeμL PEG300, mengen en helder maken, voeg vervolgens toeμL Tween 80, mengen en helder maken, voeg vervolgens toe μL ddH2O, mengen en helder maken.
Methode voor het bereiden van in vivo formulering: Neem μL DMSO mastervloeistof, voeg vervolgens toe μL Maïsolie, mengen en helder maken.
Opmerking: 1. Zorg ervoor dat de vloeistof helder is voordat u het volgende oplosmiddel toevoegt.
2. Zorg ervoor dat u het/de oplosmiddel(en) in de juiste volgorde toevoegt. U moet ervoor zorgen dat de verkregen oplossing, bij de vorige toevoeging, een heldere oplossing is voordat u verdergaat met het toevoegen van het volgende oplosmiddel. Fysische methoden zoals vortexen, echografie of een warmwaterbad kunnen worden gebruikt om het oplossen te bevorderen.
Werkingsmechanisme
| Kenmerken |
Investigated as a FLT3 inhibitor in clinical trials, with others in early development.
|
|---|---|
| Targets/IC50/Ki |
FLT3 (D835Y)
(Cell-free assay) 1 nM
Abl (T315I)
(Cell-free assay) 4 nM
FLT3
(Cell-free assay) 6.6 nM
Abl
(Cell-free assay) 14 nM
FGFR1
(Cell-free assay) 36 nM
Aurora A
(Cell-free assay) 48 nM
JAK2
(Cell-free assay) 150 nM
Kit
(Cell-free assay) 300 nM
Src
(Cell-free assay) 400 nM
|
| In vitro |
KW-2449, een multikinase-remmer van FLT3, ABL, ABL-T315I en Aurora kinase, wordt onderzocht voor de behandeling van leukemiepatiënten. Deze verbinding vertoont krachtige groeiremmende effecten op leukemiecellen met FLT3-mutaties door remming van de FLT3 kinase, resulterend in de downregulatie van gefosforyleerd-FLT3/STAT5, G1-arrest en apoptose. Orale toediening van deze chemische stof vertoont dosisafhankelijke en significante tumorgoeiremming in een xenograftmodel met FLT3-mutatie met minimale beenmergsuppressie. Bij FLT3 wild-type humane leukemie induceert het de reductie van gefosforyleerd histone H3, G2/M-arrest en apoptose. Bij Imatinib-resistente leukemie draagt dit middel bij aan het doorbreken van de resistentie door de gelijktijdige downregulatie van BCR/ABL en Aurora kinases. De remmende activiteit van deze verbinding wordt niet beïnvloed door de aanwezigheid van humaan plasmaproteïne, zoals α1-zuur glycoproteïne. Het heeft krachtige groeiremmende activiteit tegen verschillende typen leukemie door verschillende werkingsmechanismen. Deze remmer heeft significante activiteit en rechtvaardigt klinisch onderzoek bij leukemiepatiënten met FLT3-mutaties, evenals Imatinib-resistente mutaties. Fosforyleringsniveaus van FLT3 en STAT5 worden verlaagd door deze chemische stof op een dosisafhankelijke manier. Bovendien remt het potent ABL-T315I, wat geassocieerd is met IM-resistentie, met een IC50 van 4 nM. Aan de andere kant heeft deze verbinding weinig effect op PDGFRβ, IGF-1R, EGFR en verschillende serine/threonine kinases, zelfs bij een concentratie van 1 μM. Het heeft de krachtige groeiremmende activiteiten tegen niet alleen FLT3/ITD-expressende leukemiecellen, maar ook tegen FLT3/KDM-geactiveerde en wild-type FLT3-overexpresserende leukemiecellen. In overeenstemming met het groeiremmende effect onderdrukt dit middel de fosforyleringen van FLT3 (P-FLT3) en zijn stroomafwaartse molecuul phospho-STAT5 (P-STAT5) in MOLM-13-cellen op een dosisafhankelijke manier. Verder verhoogt het het percentage cellen in de G1-fase van de celcyclus en vermindert het wederkerig het percentage cellen in de S-fase, wat resulteert in de toename van de apoptotische celpopulatie. Deze verbinding kan constitutief actieve WT-FLT3 kinase defosforyleren, maar remt de proliferatie van leukemiecellen niet als deze niet voornamelijk afhankelijk zijn van de FLT3 kinase. Het wordt snel geabsorbeerd en omgezet in een belangrijke metaboliet M1. Preklinische studies onthullen dat deze chemische stof wordt omgezet door monoamine oxidase-B (MAO-B) en aldehyde oxidase in zijn belangrijkste metaboliet M1. Dit middel medieert cytotoxiciteit via remming van FLT3/ITD. Het is een directe remmer van FLT3 en induceert remming van zijn stroomafwaartse doelwit STAT5. Deze verbinding interageert synergistisch met HDACI's om apoptose in Ph+ CML-cellen te induceren op een tijd- en concentratieafhankelijke manier. Het versterkt synergistisch de dodelijkheid van vorinostat/SNDX275 in CML-cellen. Deze remmerregimes zijn actief tegen aanvullende IM-resistente Bcr/Abl+ leukemiecellen. Het vermindert matig de fosforylering van histone H3, een indicator van Aurora B-activiteit, in nocodozole-behandelde K562-cellen.
|
| Kinase Assay |
FLT3 fosforylering
|
|
Leukemiecellen worden gewassen in fosfaatgebufferde zoutoplossing (PBS), vervolgens gelyseerd door de cellen opnieuw te suspenderen in lysisbuffer (20 mM Tris pH 7.4, 100 mM NaCl, 1% Igepal, 1 mM EDTA, 2 mM NaVO4, plus complete protease-remmer KW-2449 gedurende 30 minuten terwijl geschud wordt. Het extract wordt geklaard door centrifugatie bij 1,6 × 104 g en het supernatant wordt getest op eiwit (Bio-Rad). Een aliquot van 50 μg wordt verwijderd als een hele-cellysaat voor analyse van STAT5, en de rest wordt gebruikt voor immunoprecipitatie met anti-FLT3. Anti-FLT3-antilichaam wordt toegevoegd aan het extract voor incubatie gedurende een nacht, waarna proteïne A sepharose wordt toegevoegd voor nog 2 uur. Aparte natriumdodecylsulfaat-polyacrylamide-elektroforese (SDS-PAGE) gels voor hele-cellysaat en immunoprecipitaten worden parallel uitgevoerd. Na overdracht naar Immobilon-membranen wordt immunoblotting uitgevoerd met antifosfotyrosine-antilichaam (4G10) om gefosforyleerd FLT3 te detecteren of, voor de hele-cellysaatgels, met een rat monoclonale antilichaam tegen gefosforyleerd STAT5 (residu Y694) en vervolgens gestript en opnieuw getest met anti-FLT3-antilichaam om totale FLT3 te meten. Eiwitten worden gevisualiseerd met behulp van chemiluminescentie, blootgesteld op Kodak BioMax XAR-film, ontwikkeld en gescand met behulp van een Bio-Rad GS800 densitometer. De concentratie van deze verbinding waarvoor de fosforylering van FLT3 of STAT5 wordt geremd tot 50% van de basislijn (IC50) wordt bepaald met behulp van lineaire regressieanalyse van de dosisresponscurves. Voor directe analyse van FLT3 en STAT5 in circulerende blasten wordt perifeer bloed verzameld in gehepainiseerde buizen en onmiddellijk op ijs gekoeld. Monsters worden gedurende 10 minuten gecentrifugeerd bij 900 g, bij 4 °C. Het plasma wordt verwijderd en bevroren bewaard bij −80 °C. De buffy coat wordt voorzichtig overgebracht naar ijskoud PBS, gelaagd op gekoeld Ficoll-Hypaque en gedurende 5 minuten gecentrifugeerd bij 600 g, bij 4 °C. Alle volgende stappen worden uitgevoerd bij 4 °C. Mononucleaire cellen worden verzameld en snel eenmaal gewassen in rode bloedcel-lysisbuffer (0,155 M NH4Cl, 0,01 M KHCO3, 0,1 mM EDTA), waarna eenmaal gewassen in PBS. Cellen worden vervolgens gelyseerd zoals beschreven voor FLT3- en STAT5-analyse.
|
|
| In vivo |
In het MOLM-13 tumoren xenograftmodel vertoont orale toediening van KW-2449 gedurende 14 dagen een krachtig en significant antitumor effect op een dosisafhankelijke manier.
|
Referenties |
|
Informatie klinische proef
(gegevens van https://clinicaltrials.gov, bijgewerkt op 2024-05-22)
| NCT-nummer | Rekrutering | Aandoeningen | Sponsor/Medewerkers | Startdatum | Fasen |
|---|---|---|---|---|---|
| NCT00346632 | Terminated | Acute Myelogenous Leukemia|Acute Lymphoblastic Leukemia|Myelodysplastic Syndromes|Chronic Myelogenous Leukemia |
Kyowa Kirin Inc. |
June 2006 | Phase 1 |
Technische ondersteuning
Tel: +1-832-582-8158 Ext:3
Als u nog andere vragen heeft, kunt u een bericht achterlaten.
