Nur für Forschungszwecke
Anti-DYKDDDDK Tag magnetic beads
Anti-DYKDDDDK Tag magnetische Beads basiert auf Hydroxyl-Magnetkügelchen, die kovalent mit einem hochwertigen rekombinanten monoklonalen Mausantikörper gekoppelt sind. Mit hoher Beladung von DYKDDDDK-markiertem Protein (mehr als 0,6 mg Protein/mL) und hoher Spezifität wird es für die Co-Immunpräzipitation und Proteinreinigung empfohlen.
Sellecks Wurde zitiert von 119 Publikationen
Vorteile
Zeitersparnis: spart 15-30 min im Vergleich zu Agarose-Beads.
Einfache Bedienung: Magnetische Trennung und zentrifugationsfrei.
Hohe Proteinbeladungskapazität.
Hohe Spezifität.
Produktvergleich
Beschreibung
Anti-DYKDDDDK Tag magnetische Beads basiert auf Hydroxyl-Magnetkügelchen, die kovalent mit einem hochwertigen rekombinanten monoklonalen Mausantikörper gekoppelt sind. Mit hoher Beladung von DYKDDDDK-markiertem Protein (mehr als 0,6 mg Protein/mL) und hoher Spezifität wird es für die Co-Immunpräzipitation und Proteinreinigung empfohlen.
Eigenschaften
| Antikörper-Isotyp | Rekombinanter monoklonaler Mausantikörper |
|---|---|
| Antikörperreinigung | Protein A gereinigt |
| Anwendung | Immunpräzipitation und Proteinreinigung |
| Empfohlenes Volumen | IP: 20 μl Beads für 200 μl Rohproteinlösung |
| Bindungskapazität | Mindestens 0,6 mg Protein pro ml Magnetkügelchen eluiert |
| Bindungseigenschaften | Met-N-terminales DYKDDDDK Tag-Fusionsprotein: Met-DYKDDDDK Tag–Protein N-terminales DYKDDDDK Tag-Fusionsprotein: DYKDDDDK Tag–Protein C-terminales DYKDDDDK Tag-Fusionsprotein: Protein-DYKDDDDK Tag |
Lagerung (ab dem Datum des Erhalts)
Bei 2-8°C für 2 Jahre lagern.
Protokoll
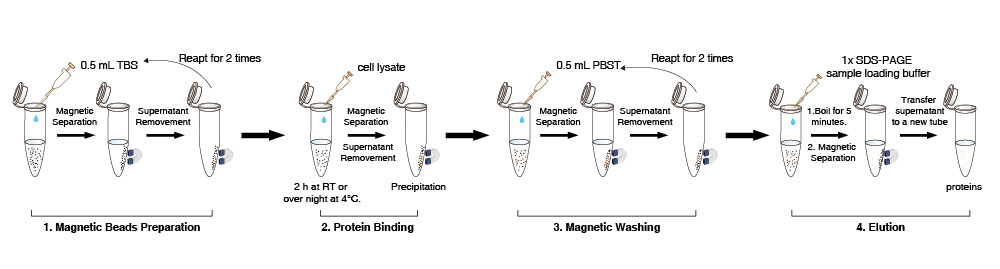
Vorbereitung der Magnetkügelchen
1. Die Anti-DYKDDDDK Tag-Magnetkügelchen in der Durchstechflasche suspendieren (10 Mal vorsichtig pipettieren, nicht vortexen). 10 µL (die Menge kann je nach Bedarf skaliert werden) Anti-DYKDDDDK Tag-Magnetkügelchensuspension in ein neues Röhrchen überführen.
2. 0,5 mL TBS-Puffer (50 mM Tris HCl, 150 mM NaCl, pH 7,4) hinzufügen. Anti-DYKDDDDK Tag-Magnetkügelchen 5 Mal vorsichtig pipettieren. Das Röhrchen 1-2 min auf den Magneten stellen, um die Beads von der Lösung zu trennen (kann entsprechend auf 5 Minuten verlängert werden), und den Überstand entfernen. Diesen Schritt 2 Mal wiederholen.
Hinweis: Alle Magnetkügelchen zusammen in einem großen Röhrchen vorbereiten und dann in Aliquots aufteilen, wenn Proben stapelweise vorliegen. Beim Entfernen des Überstands bitte vorsichtig saugen, da übermäßiges Saugen zum Verlust einiger Magnetkügelchen führen kann.
Proteinbindung
3. 500 µL Zelllysat zu den gewaschenen Magnetkügelchen geben. Das Röhrchen 2 h bei Raumtemperatur oder über Nacht bei 4°C sanft rotieren.
4. Das Röhrchen 1-2 min auf den Magneten stellen, um die Beads von der Lösung zu trennen (kann entsprechend verlängert werden), und dann den Überstand in ein neues Röhrchen überführen, um festzustellen, ob DYKDDDDK-Tag-Proteinreste vorhanden sind.
Hinweis: Während des Bindungsprozesses hat es keinen Einfluss auf das Ergebnis, wenn Magnetkügelchen gelegentlich zusammenklumpen.
Magnetische Waschung
5. 500 µL PBST zum Röhrchen geben (NaCl 136,89 mM; KCl 2,67 mM; Na2HPO4 8,1 mM; KH2PO4 1,76 mM; 0,5% Tween20), die Magnetkügelchen durch vorsichtiges Pipettieren resuspendieren. Dann das Röhrchen 5 min rotieren. Das Röhrchen 10 Sek. auf den Magneten stellen, um die Beads von der Lösung zu trennen, und den Überstand entfernen.
6. Schritt 5 etwa 2 Mal wiederholen. Wenn unspezifische Verunreinigungsproteine zurückbleiben, bitte die Reinigungszeit verlängern, die Reinigungsanzahl erhöhen oder den Detergenzgehalt in der Reinigungslösung entsprechend erhöhen.
Elution und Nachweis
Wählen Sie je nach nachgeschalteter Verwendung unterschiedliche Elutionsmethoden. Für IP gehen Sie zu Schritt 7-8. Für die Proteinreinigung gehen Sie zu Schritt 9-10 für die Elution bei niedrigem pH-Wert.
Denaturierende Elution (geeignet für IP-Experimente mit Anti-DYKDDDDK Tag-Beads):
7. Zum direkten Nachweis von Zielproteinen 50 µL 1×Proteinprobenladepuffer zur oben genannten Präzipitation geben, 5 min kochen, auf Raumtemperatur abkühlen lassen und dann das Röhrchen 1-2 min auf den Magneten stellen, um die Beads von der Lösung zu trennen (kann entsprechend verlängert werden).
8. Den Überstand mittels SDS-PAGE nachweisen.
Kompetitive Poly-DYKDDDDK Tag-Polypeptid-Elution (geeignet für Proteinreinigungen mit Anti-DYKDDDDK Tag-Beads):
9. Den TBS-Puffer mit 200 µg-1 mg/mL Poly-DYKDDDDK Tag-Peptid (B23111) zum Produkt von Schritt 6 geben und dann 2 h auf einem Schüttler (4°C) inkubieren. Im Allgemeinen ist das Volumen des Poly-DYKDDDDK Tag-Peptids das 5-fache des Gels.
10. Produkte des obigen Schritts zur magnetischen Trennung auf den Magneten stellen. Den Überstand, der das Zielprotein enthält, in ein neues EP-Röhrchen überführen. Falls die Magnetkügelchen wiederverwendet werden sollen, reinigen Sie das Gel mit 0,1 M Glycin HCl (pH 3,0) und führen Sie das Recycling durch.
Niedrig-pH-Elution (geeignet für Proteinreinigung mit Anti-DYKDDDDK Tag-Beads):
11. Den 0,1 M Glycin HCl (pH 3,0) Elutionspuffer zum Produkt von Schritt 6 geben und 5 min auf einem Schüttler inkubieren (Die Elutionszeit sollte weniger als 20 min betragen). Im Allgemeinen ist das Volumen des Elutionspuffers das 5-fache des Gels.
12. Produkte des obigen Schritts 30 Sek. bei 5000 U/min zentrifugieren. Dann das Elutionsprodukt schnell in 1 M Tris (pH 8,0) zur Neutralisation überführen, bis der pH-Wert nahe am Neutralbereich liegt.
Fehlerbehebung
| Problem | Mögliche Ursache | Vorgeschlagene Verbesserung |
|---|---|---|
| Hoher Hintergrund | Unspezifische Bindung von Proteinen an den Antikörper, Magnetkügelchen oder EP-Röhrchen | Lysat vorklären, um unspezifisch bindende Proteine zu entfernen. Nach dem Suspendieren der Beads für die letzte Wäsche die gesamte Probe in ein sauberes EP-Röhrchen überführen und dann magnetisch trennen. |
| Waschzeiten sind nicht ausreichend. | Anzahl der Waschvorgänge erhöhen. Dauer der Waschvorgänge erhöhen. |
|
| Kein Signal beobachtet. | DYKDDDDK-markiertes Protein wird in der Probe nicht exprimiert. | Sicherstellen, dass das interessierende Protein die DYKDDDDK Tag-Sequenz enthält. Frisches Lysat herstellen. Geeignete Proteaseinhibitoren verwenden. |
| Inkubationszeiten sind unzureichend. | Inkubationszeiten erhöhen. | |
| Störende Substanz ist in der Probe vorhanden. | Das Lysat kann hohe Konzentrationen an Dithiothreitol (DTT), 2-Mercaptoethanol oder anderen Reduktionsmitteln enthalten. Übermäßige Detergenzkonzentration kann die Antikörper-Antigen-Wechselwirkung stören. |
Dateidownload
Verwandte andere Produkte
Technischer Support
Wenn Sie weitere Anfragen haben, hinterlassen Sie bitte eine Nachricht.
