nur für Forschungszwecke
Benznidazole Parasite Inhibitor
Kat.-Nr.S3741
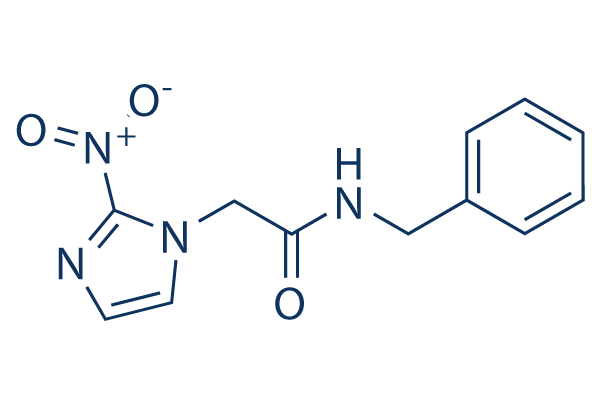
Chemische Struktur
Molekulargewicht: 260.25
Qualitätskontrolle
| Verwandte Ziele | Integrase Bacterial Antibiotics Anti-infection Fungal Antiviral COVID-19 Reverse Transcriptase HIV HCV Protease |
|---|---|
| Weitere Parasite Inhibitoren | Diminazene Aceturate Oxibendazole Avermectin B1 Oxfendazole Diclazuril Arteether Milbemycin Oxime (+/-)-nerolidol Selamectin Emodepside |
Chemische Informationen, Lagerung & Stabilität
| Molekulargewicht | 260.25 | Formel | C12H12N4O3 |
Lagerung (Ab dem Eingangsdatum) | |
|---|---|---|---|---|---|
| CAS-Nr. | 22994-85-0 | SDF herunterladen | Lagerung von Stammlösungen |
|
|
| Synonyme | Radanil | Smiles | C1=CC=C(C=C1)CNC(=O)CN2C=CN=C2[N+](=O)[O-] | ||
Löslichkeit
|
In vitro |
DMSO
: 52 mg/mL
(199.8 mM)
Ethanol : 5 mg/mL Water : Insoluble |
Molaritätsrechner
|
In vivo |
|||||
In-vivo-Formulierungsrechner (Klare Lösung)
Schritt 1: Geben Sie die untenstehenden Informationen ein (Empfohlen: Ein zusätzliches Tier zur Berücksichtigung von Verlusten während des Experiments)
Schritt 2: Geben Sie die In-vivo-Formulierung ein (Dies ist nur der Rechner, keine Formulierung. Bitte kontaktieren Sie uns zuerst, wenn es im Abschnitt "Löslichkeit" keine In-vivo-Formulierung gibt.)
Berechnungsergebnisse:
Arbeitskonzentration: mg/ml;
Methode zur Herstellung der DMSO-Stammlösung: mg Wirkstoff vorgelöst in μL DMSO ( Konzentration der Stammlösung mg/mL, Bitte kontaktieren Sie uns zuerst, wenn die Konzentration die DMSO-Löslichkeit der Wirkstoffcharge überschreitet. )
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügenμL PEG300, mischen und klären, dann hinzufügenμL Tween 80, mischen und klären, dann hinzufügen μL ddH2O, mischen und klären.
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügen μL Maisöl, mischen und klären.
Hinweis: 1. Bitte stellen Sie sicher, dass die Flüssigkeit klar ist, bevor Sie das nächste Lösungsmittel hinzufügen.
2. Achten Sie darauf, das/die Lösungsmittel der Reihe nach hinzuzufügen. Sie müssen sicherstellen, dass die bei der vorherigen Zugabe erhaltene Lösung eine klare Lösung ist, bevor Sie mit der Zugabe des nächsten Lösungsmittels fortfahren. Physikalische Methoden wie Vortex, Ultraschall oder ein heißes Wasserbad können zur Unterstützung des Lösens verwendet werden.
Wirkmechanismus
| In vitro |
Benznidazole (BZL) hemmt die Proliferation leukämischer nicht-adhärenter Zellen durch Kontrolle des Zellzyklus in der G0/G1-Zellphase durch Hochregulierung von p27. Die durch diese Verbindung induzierte Wachstumshemmung ist ein reversibler Prozess, der nicht von signifikantem Zelltod begleitet wird. Neben seiner trypanoziden Aktivität hat es auch eine immunmodulatorische Wirkung auf Makrophagen, indem es die Transkription einiger proinflammatorischer Mediatoren blockiert, ohne die Interleukin-10-Expression zu verändern.
|
|---|---|
| In vivo |
Bei Mäusen betrug nach oraler Verabreichung von Benznidazole (100 mg/kg): die Zeit bis zum Erreichen der maximalen Konzentration (Tmax) im Plasma 0,83 h und die maximale Konzentration (Cmax) im Plasma 41,61 μg/ml. Die Eliminationshalbwertszeit (t1/2b) dieser Verbindung betrug 2,03 h und die mittlere Verweildauer (MRT) 3,86 h. Das Verteilungsvolumen (V) und die Clearance (CL), beide als Funktion ihrer Bioverfügbarkeit (F), betrugen 38,81 ml bzw. 13,29 ml/h. Bei oral behandelten Wistar-Ratten betrugen die Tmaxs dieser Chemikalie 2,0 bzw. 1,1 h. Tmaxs von 15, 30 oder 60 min, abhängig von der Dosis, bei BALB/c-Mäusen nach intraperitonealer Behandlung und Tmaxs von 1 bis 5 h bei oral behandelten Hunden. Es kann die Blut-Hirn-Schranke überwinden und seine Wirkung bei Parasite des zentralen Nervensystems entfalten. Andere Studien haben jedoch gezeigt, dass diese Verbindung toxische Wirkungen im zentralen Nervensystem hat. Oral mit Benznidazole behandelte Hunde zeigten Enzephalopathie mit multifokalen Merkmalen und klinischen, pathologischen und neurologischen Störungen, die dosis- und zeitabhängig waren. Seine Biodistribution erfolgt breitflächig und erreicht Herz und Dickdarm, die die relevantesten Organe für eine T. cruzi-Infektion sind, sowie Milz, Gehirn, Leber, Lunge und Nieren.
|
Literatur |
|
Klinische Studieninformationen
(Daten von https://clinicaltrials.gov, aktualisiert am 2024-05-22)
| NCT-Nummer | Rekrutierung | Erkrankungen | Sponsor/Kooperationspartner | Startdatum | Phasen |
|---|---|---|---|---|---|
| NCT03892213 | Completed | Chagas Disease |
Drugs for Neglected Diseases|PhinC Development |
October 2014 | Phase 1 |
| NCT01755403 | Completed | Chagas Disease |
Barcelona Centre for International Health Research |
December 2012 | Phase 4 |
| NCT01547533 | Completed | Chagas Disease|Lactation |
Hospital de Niños R. Gutierrez de Buenos Aires |
August 2011 | -- |
| NCT01489228 | Unknown status | Chronic Chagas Disease Indeterminate |
Drugs for Neglected Diseases|Eisai Co. Ltd. |
June 2011 | Phase 2 |
| NCT00699387 | Completed | Chagas Disease |
Hospital de Niños R. Gutierrez de Buenos Aires|Thrasher Research Fund|The Hospital for Sick Children|Fundacion Bunge y Born (Argentina)|Universidad Nacional de La Plata|Consejo de Investigacion en Salud Gobierno de Buenos Aires |
April 2007 | Not Applicable |
Technischer Support
Tel: +1-832-582-8158 Ext:3
Wenn Sie weitere Fragen haben, hinterlassen Sie bitte eine Nachricht.
