nur für Forschungszwecke
Valganciclovir HCl CMV Hemmer
Kat.-Nr.S4050
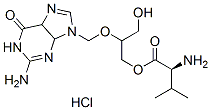
Chemische Struktur
Molekulargewicht: 390.82
Qualitätskontrolle
| Verwandte Ziele | Integrase Bacterial Antibiotics Anti-infection Fungal Antiviral COVID-19 Parasite Reverse Transcriptase HIV |
|---|---|
| Weitere CMV Inhibitoren | Valaciclovir HCl Bisindolylmaleimide IV Brivudine (BVDU) |
Chemische Informationen, Lagerung & Stabilität
| Molekulargewicht | 390.82 | Formel | C14H22N6O5.HCl |
Lagerung (Ab dem Eingangsdatum) | |
|---|---|---|---|---|---|
| CAS-Nr. | 175865-59-5 | SDF herunterladen | Lagerung von Stammlösungen |
|
|
| Synonyme | N/A | Smiles | CC(C)C(C(=O)OCC(CO)OCN1C=NC2=C1N=C(NC2=O)N)N.Cl | ||
Löslichkeit
|
In vitro |
DMSO
: 78 mg/mL
(199.58 mM)
Water : 78 mg/mL Ethanol : Insoluble |
Molaritätsrechner
|
In vivo |
|||||
In-vivo-Formulierungsrechner (Klare Lösung)
Schritt 1: Geben Sie die untenstehenden Informationen ein (Empfohlen: Ein zusätzliches Tier zur Berücksichtigung von Verlusten während des Experiments)
Schritt 2: Geben Sie die In-vivo-Formulierung ein (Dies ist nur der Rechner, keine Formulierung. Bitte kontaktieren Sie uns zuerst, wenn es im Abschnitt "Löslichkeit" keine In-vivo-Formulierung gibt.)
Berechnungsergebnisse:
Arbeitskonzentration: mg/ml;
Methode zur Herstellung der DMSO-Stammlösung: mg Wirkstoff vorgelöst in μL DMSO ( Konzentration der Stammlösung mg/mL, Bitte kontaktieren Sie uns zuerst, wenn die Konzentration die DMSO-Löslichkeit der Wirkstoffcharge überschreitet. )
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügenμL PEG300, mischen und klären, dann hinzufügenμL Tween 80, mischen und klären, dann hinzufügen μL ddH2O, mischen und klären.
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügen μL Maisöl, mischen und klären.
Hinweis: 1. Bitte stellen Sie sicher, dass die Flüssigkeit klar ist, bevor Sie das nächste Lösungsmittel hinzufügen.
2. Achten Sie darauf, das/die Lösungsmittel der Reihe nach hinzuzufügen. Sie müssen sicherstellen, dass die bei der vorherigen Zugabe erhaltene Lösung eine klare Lösung ist, bevor Sie mit der Zugabe des nächsten Lösungsmittels fortfahren. Physikalische Methoden wie Vortex, Ultraschall oder ein heißes Wasserbad können zur Unterstützung des Lösens verwendet werden.
Wirkmechanismus
| In vitro |
Valganciclovirhydrochlorid ist ein Hydrochloridsalz des L-Valylesters von Ganciclovir, das als Mischung aus zwei Diastereomeren vorliegt. Nach der Verabreichung werden diese Diastereomere durch hepatische und intestinale Esterasen schnell in Ganciclovir umgewandelt. In Cytomegalovirus (CMV)-infizierten Zellen wird Ganciclovir zunächst durch virale Proteinkinase zur Monophosphatform phosphoryliert, dann wird es durch zelluläre Kinasen weiter phosphoryliert, um die Triphosphatform zu bilden. Diese Triphosphatform wird intrazellulär langsam metabolisiert. Die Phosphorylierung ist von der viralen Kinase abhängig und erfolgt bevorzugt in virusinfizierten Zellen. Die virustatische Aktivität von Ganciclovir beruht auf der Hemmung der viralen DNA-Synthese durch Ganciclovir-Triphosphat. Ganciclovir-Triphosphat wird in den DNA-Strang eingebaut und ersetzt viele der Adenosinbasen. Dies führt zur Verhinderung der DNA-Synthese, da Phosphodiesterbrücken nicht länger gebaut werden können, wodurch der Strang destabilisiert wird. Ganciclovir hemmt virale DNA-Polymerasen wirksamer als zelluläre Polymerasen, und die Kettenverlängerung wird wieder aufgenommen, wenn Ganciclovir entfernt wird.
|
|---|---|
| In vivo |
Nach oraler Verabreichung hydrolysieren intestinale und hepatische Esterasen beide Diastereomere zu Ganciclovir, das die Replikation des humanen Cytomegalovirus hemmt. Valganciclovir wird gut aus dem Magen-Darm-Trakt resorbiert, und die absolute Bioverfügbarkeit von Valganciclovir-Tabletten (nach Einnahme mit Nahrung) beträgt etwa 60 %.
|
Literatur |
|
Klinische Studieninformationen
(Daten von https://clinicaltrials.gov, aktualisiert am 2024-05-22)
| NCT-Nummer | Rekrutierung | Erkrankungen | Sponsor/Kooperationspartner | Startdatum | Phasen |
|---|---|---|---|---|---|
| NCT06407232 | Not yet recruiting | Cytomegalovirus Infections|Kidney Transplant Infection|Pancreas Transplant |
University of Wisconsin Madison|Merck Sharp & Dohme LLC |
May 2024 | Phase 3 |
| NCT06034925 | Recruiting | Transplant Complication|CMV |
Medical University of South Carolina|Takeda |
November 6 2023 | Phase 4 |
| NCT03301415 | Terminated | Congenital Cytomegalovirus Infection |
National Institute of Allergy and Infectious Diseases (NIAID) |
August 21 2019 | Phase 2 |
| NCT03698435 | Unknown status | Cytomegalovirus Infections |
University Medical Center Groningen |
May 25 2018 | -- |
Technischer Support
Tel: +1-832-582-8158 Ext:3
Wenn Sie weitere Fragen haben, hinterlassen Sie bitte eine Nachricht.
