nur für Forschungszwecke
CC-5013 (Lenalidomide) Immunmodulator
Kat.-Nr.S1029
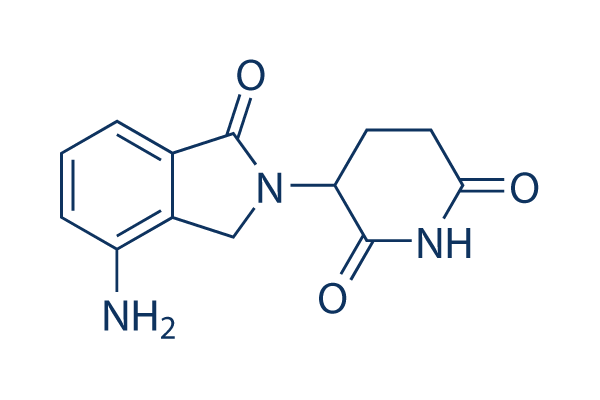
Chemische Struktur
Molekulargewicht: 259.26
Qualitätskontrolle
| Verwandte Ziele | Proteasome E1 Activating E3 Ligase DUB p97 SUMO E2 conjugating |
|---|---|
| Weitere E3 ligase Ligand Inhibitoren | CC-99282 |
Zellkultur, Behandlung & Arbeitskonzentration
| Zelllinien | Assay-Typ | Konzentration | Inkubationszeit | Formulierung | Aktivitätsbeschreibung | PMID |
|---|---|---|---|---|---|---|
| LB771-HNC | Growth Inhibition Assay | IC50=2.15038 μM | SANGER | |||
| L-363 | Growth Inhibition Assay | IC50=2.92212 μM | SANGER | |||
| JAR | Growth Inhibition Assay | IC50=2.97001 μM | SANGER | |||
| EoL-1-cell | Growth Inhibition Assay | IC50=4.10515 μM | SANGER | |||
| BT-549 | Growth Inhibition Assay | IC50=6.21849 μM | SANGER | |||
| SK-NEP-1 | Growth Inhibition Assay | IC50=7.89512 μM | SANGER | |||
| BV-173 | Growth Inhibition Assay | IC50=8.67585 μM | SANGER | |||
| HMV-II | Growth Inhibition Assay | IC50=10.0172 μM | SANGER | |||
| HCC1806 | Growth Inhibition Assay | IC50=11.4467 μM | SANGER | |||
| KASUMI-1 | Growth Inhibition Assay | IC50=11.571 μM | SANGER | |||
| SK-MEL-28 | Growth Inhibition Assay | IC50=11.9764 μM | SANGER | |||
| RPMI-8226 | Growth Inhibition Assay | IC50=12.6241 μM | SANGER | |||
| T47D | Growth Inhibition Assay | IC50=13.2099 μM | SANGER | |||
| HOP-62 | Growth Inhibition Assay | IC50=13.48 μM | SANGER | |||
| A2058 | Growth Inhibition Assay | IC50=13.8199 μM | SANGER | |||
| SW620 | Growth Inhibition Assay | IC50=14.2473 μM | SANGER | |||
| LCLC-103H | Growth Inhibition Assay | IC50=14.4892 μM | SANGER | |||
| HAL-01 | Growth Inhibition Assay | IC50=14.5796 μM | SANGER | |||
| PANC-08-13 | Growth Inhibition Assay | IC50=14.9108 μM | SANGER | |||
| COLO-684 | Growth Inhibition Assay | IC50=15.3979 μM | SANGER | |||
| DEL | Growth Inhibition Assay | IC50=15.499 μM | SANGER | |||
| K5 | Growth Inhibition Assay | IC50=16.1486 μM | SANGER | |||
| SK-MEL-24 | Growth Inhibition Assay | IC50=16.4652 μM | SANGER | |||
| ACN | Growth Inhibition Assay | IC50=16.5297 μM | SANGER | |||
| H9 | Growth Inhibition Assay | IC50=16.626 μM | SANGER | |||
| EM-2 | Growth Inhibition Assay | IC50=17.143 μM | SANGER | |||
| HSC-4 | Growth Inhibition Assay | IC50=17.6601 μM | SANGER | |||
| IGROV-1 | Growth Inhibition Assay | IC50=17.783 μM | SANGER | |||
| TE-1 | Growth Inhibition Assay | IC50=17.9968 μM | SANGER | |||
| LN-405 | Growth Inhibition Assay | IC50=19.9076 μM | SANGER | |||
| MSTO-211H | Growth Inhibition Assay | IC50=20.3573 μM | SANGER | |||
| MOLT-4 | Growth Inhibition Assay | IC50=20.5759 μM | SANGER | |||
| RS4-11 | Growth Inhibition Assay | IC50=22.1563 μM | SANGER | |||
| ES3 | Growth Inhibition Assay | IC50=22.6963 μM | SANGER | |||
| SBC-1 | Growth Inhibition Assay | IC50=23.8696 μM | SANGER | |||
| CTV-1 | Growth Inhibition Assay | IC50=25.0149 μM | SANGER | |||
| HuP-T3 | Growth Inhibition Assay | IC50=25.4009 μM | SANGER | |||
| HCC2218 | Growth Inhibition Assay | IC50=25.5407 μM | SANGER | |||
| HDLM-2 | Growth Inhibition Assay | IC50=28.2026 μM | SANGER | |||
| ABC-1 | Growth Inhibition Assay | IC50=29.6974 μM | SANGER | |||
| MV-4-11 | Growth Inhibition Assay | IC50=29.7317 μM | SANGER | |||
| WM-115 | Growth Inhibition Assay | IC50=30.3099 μM | SANGER | |||
| SW1990 | Growth Inhibition Assay | IC50=30.33 μM | SANGER | |||
| HCC70 | Growth Inhibition Assay | IC50=30.7346 μM | SANGER | |||
| KYSE-520 | Growth Inhibition Assay | IC50=30.8839 μM | SANGER | |||
| JEG-3 | Growth Inhibition Assay | IC50=31.1614 μM | SANGER | |||
| C8166 | Growth Inhibition Assay | IC50=31.2274 μM | SANGER | |||
| SK-OV-3 | Growth Inhibition Assay | IC50=31.6755 μM | SANGER | |||
| NCI-H526 | Growth Inhibition Assay | IC50=32.683 μM | SANGER | |||
| NKM-1 | Growth Inhibition Assay | IC50=32.9568 μM | SANGER | |||
| ECC10 | Growth Inhibition Assay | IC50=34.7443 μM | SANGER | |||
| A2780 | Growth Inhibition Assay | IC50=35.3601 μM | SANGER | |||
| KY821 | Growth Inhibition Assay | IC50=35.7681 μM | SANGER | |||
| MKN1 | Growth Inhibition Assay | IC50=36.2137 μM | SANGER | |||
| EKVX | Growth Inhibition Assay | IC50=37.4212 μM | SANGER | |||
| EW-16 | Growth Inhibition Assay | IC50=38.3885 μM | SANGER | |||
| CTB-1 | Growth Inhibition Assay | IC50=39.7789 μM | SANGER | |||
| COR-L105 | Growth Inhibition Assay | IC50=40.4746 μM | SANGER | |||
| NCI-SNU-5 | Growth Inhibition Assay | IC50=41.2069 μM | SANGER | |||
| Mewo | Growth Inhibition Assay | IC50=41.9871 μM | SANGER | |||
| BCPAP | Growth Inhibition Assay | IC50=43.7917 μM | SANGER | |||
| KARPAS-45 | Growth Inhibition Assay | IC50=44.2776 μM | SANGER | |||
| NCI-H1693 | Growth Inhibition Assay | IC50=46.6986 μM | SANGER | |||
| H-EMC-SS | Growth Inhibition Assay | IC50=48.3224 μM | SANGER | |||
| 697 | Growth Inhibition Assay | IC50=50.3545 μM | SANGER | |||
| KP-N-YS | Growth Inhibition Assay | IC50=52.3142 μM | SANGER | |||
| NCI-H1304 | Growth Inhibition Assay | IC50=52.7024 μM | SANGER | |||
| NOS-1 | Growth Inhibition Assay | IC50=52.8559 μM | SANGER | |||
| NCI-H2342 | Growth Inhibition Assay | IC50=53.0508 μM | SANGER | |||
| KYSE-270 | Growth Inhibition Assay | IC50=53.6364 μM | SANGER | |||
| LU-135 | Growth Inhibition Assay | IC50=55.1853 μM | SANGER | |||
| OE33 | Growth Inhibition Assay | IC50=55.818 μM | SANGER | |||
| ML-2 | Growth Inhibition Assay | IC50=55.9489 μM | SANGER | |||
| KMOE-2 | Growth Inhibition Assay | IC50=56.2893 μM | SANGER | |||
| Daoy | Growth Inhibition Assay | IC50=56.3204 μM | SANGER | |||
| KNS-62 | Growth Inhibition Assay | IC50=57.0142 μM | SANGER | |||
| NBsusSR | Growth Inhibition Assay | IC50=57.5705 μM | SANGER | |||
| UACC-257 | Growth Inhibition Assay | IC50=58.6264 μM | SANGER | |||
| LU-139 | Growth Inhibition Assay | IC50=58.826 μM | SANGER | |||
| CAL-85-1 | Growth Inhibition Assay | IC50=58.8643 μM | SANGER | |||
| NCI-H720 | Growth Inhibition Assay | IC50=58.8942 μM | SANGER | |||
| MLMA | Growth Inhibition Assay | IC50=59.091 μM | SANGER | |||
| A3-KAW | Growth Inhibition Assay | IC50=59.2809 μM | SANGER | |||
| Ramos-2G6-4C10 | Growth Inhibition Assay | IC50=59.6287 μM | SANGER | |||
| A388 | Growth Inhibition Assay | IC50=60.449 μM | SANGER | |||
| LAMA-84 | Growth Inhibition Assay | IC50=60.9905 μM | SANGER | |||
| GCT | Growth Inhibition Assay | IC50=61.0786 μM | SANGER | |||
| K-562 | Growth Inhibition Assay | IC50=61.5333 μM | SANGER | |||
| NCI-H1666 | Growth Inhibition Assay | IC50=61.875 μM | SANGER | |||
| NCI-H1993 | Growth Inhibition Assay | IC50=63.4043 μM | SANGER | |||
| NCI-H358 | Growth Inhibition Assay | IC50=65.0121 μM | SANGER | |||
| NB6 | Growth Inhibition Assay | IC50=65.988 μM | SANGER | |||
| HCE-T | Growth Inhibition Assay | IC50=67.0798 μM | SANGER | |||
| DOK | Growth Inhibition Assay | IC50=67.4948 μM | SANGER | |||
| HT-1376 | Growth Inhibition Assay | IC50=69.8314 μM | SANGER | |||
| NEC8 | Growth Inhibition Assay | IC50=70.1243 μM | SANGER | |||
| G-402 | Growth Inhibition Assay | IC50=70.9395 μM | SANGER | |||
| GR-ST | Growth Inhibition Assay | IC50=71.172 μM | SANGER | |||
| QIMR-WIL | Growth Inhibition Assay | IC50=71.4434 μM | SANGER | |||
| CHP-212 | Growth Inhibition Assay | IC50=71.965 μM | SANGER | |||
| KU812 | Growth Inhibition Assay | IC50=72.9702 μM | SANGER | |||
| Becker | Growth Inhibition Assay | IC50=73.1489 μM | SANGER | |||
| ChaGo-K-1 | Growth Inhibition Assay | IC50=74.7486 μM | SANGER | |||
| A498 | Growth Inhibition Assay | IC50=74.9308 μM | SANGER | |||
| NCI-H69 | Growth Inhibition Assay | IC50=75.7663 μM | SANGER | |||
| NCI-H209 | Growth Inhibition Assay | IC50=78.6147 μM | SANGER | |||
| CAL-33 | Growth Inhibition Assay | IC50=78.9939 μM | SANGER | |||
| COLO-680N | Growth Inhibition Assay | IC50=79.1007 μM | SANGER | |||
| D-283MED | Growth Inhibition Assay | IC50=79.812 μM | SANGER | |||
| ATN-1 | Growth Inhibition Assay | IC50=81.1187 μM | SANGER | |||
| NCI-N87 | Growth Inhibition Assay | IC50=81.7296 μM | SANGER | |||
| MHH-NB-11 | Growth Inhibition Assay | IC50=81.8849 μM | SANGER | |||
| HEL | Growth Inhibition Assay | IC50=82.4134 μM | SANGER | |||
| NB69 | Growth Inhibition Assay | IC50=83.0033 μM | SANGER | |||
| MPP-89 | Growth Inhibition Assay | IC50=83.2575 μM | SANGER | |||
| COLO-829 | Growth Inhibition Assay | IC50=85.4912 μM | SANGER | |||
| ONS-76 | Growth Inhibition Assay | IC50=85.7908 μM | SANGER | |||
| EW-3 | Growth Inhibition Assay | IC50=86.2032 μM | SANGER | |||
| EW-11 | Growth Inhibition Assay | IC50=86.4336 μM | SANGER | |||
| SW900 | Growth Inhibition Assay | IC50=87.2053 μM | SANGER | |||
| MOLT-13 | Growth Inhibition Assay | IC50=87.2243 μM | SANGER | |||
| HuP-T4 | Growth Inhibition Assay | IC50=91.0405 μM | SANGER | |||
| HCC1419 | Growth Inhibition Assay | IC50=91.6374 μM | SANGER | |||
| CAL-72 | Growth Inhibition Assay | IC50=92.0219 μM | SANGER | |||
| Mo-T | Growth Inhibition Assay | IC50=92.7697 μM | SANGER | |||
| OC-314 | Growth Inhibition Assay | IC50=92.8821 μM | SANGER | |||
| BHT-101 | Growth Inhibition Assay | IC50=93.1 μM | SANGER | |||
| EW-18 | Growth Inhibition Assay | IC50=93.8462 μM | SANGER | |||
| TE-12 | Growth Inhibition Assay | IC50=94.3055 μM | SANGER | |||
| MDA-MB-361 | Growth Inhibition Assay | IC50=96.0516 μM | SANGER | |||
| DF15 | Function assay | 4 hrs | Induction of CRL4/CRBN ubiquitin ligase-mediated aiolos degradation in human DF15 cells expressing pLOC-ePL-tagged aiolos after 4 hrs by luminescence based beta-galactosidase enzyme fragmentation complementation assay, EC50 = 0.053 μM. | 28358507 | ||
| DF15 | Function assay | 4 hrs | Induction of cereblon-mediated ikaros degradation in human DF15 cells expressing ePL-tagged ikaros after 4 hrs by luminometric analysis, EC50 = 0.067 μM. | 28425720 | ||
| DF15 | Function assay | 4 hrs | Induction of cereblon-mediated aiolos degradation in human DF15 cells expressing ePL-tagged aiolos after 4 hrs by luminometric analysis, EC50 = 0.087 μM. | 28425720 | ||
| T-cells | Function assay | 2 to 3 days | Inhibition of IL-2 production in human T cells measured after 2 to 3 days by ELISA, EC50 = 0.15 μM. | 23168019 | ||
| NAMALWA | Antiproliferative assay | 72 hrs | Antiproliferative activity against human NAMALWA cells assessed as inhibition of [3H]thymidine incorporation after 72 hrs by scintillation counting, IC50 = 0.36 μM. | 23168019 | ||
| CD34+ progenitor cells | Function assay | 14 days | Decrease in erythroid differentiation of CD34+ progenitor cells from myelodysplastic syndrome del(5q) patient assessed as CD36 expression after 14 days | 17576924 | ||
| CD34+ progenitor cells | Function assay | 14 days | Decrease in myeloid differentiation of CD34+ progenitor cells from myelodysplastic syndrome del(5q) patient assessed as CD33 expression after 14 days | 17576924 | ||
| CD34+ progenitor cells | Function assay | 14 days | Decrease in erythroid differentiation of CD34+ progenitor cells from myelodysplastic syndrome del(5q) patient assessed as glycophorin A expression after 14 days | 17576924 | ||
| CD34+ progenitor cells | Growth inhibition assay | 14 days | Inhibition of cell proliferation of CD34+ progenitor cells from myelodysplastic syndrome del(5q) patient after 14 days | 17576924 | ||
| CD34+ progenitor cells | Growth inhibition assay | 14 days | Growth inhibition of CD34+ progenitor cells from non-del(5q) myelodysplastic syndrome patient after 14 days | 17576924 | ||
| DF15 | Function assay | 0.1 to 10 uM | 5 hrs | Induction of cereblon-mediated aiolos degradation in human DF15 cells at 0.1 to 10 uM after 5 hrs by immunoblot analysis | 28425720 | |
| OPM2 | Function assay | 0.1 to 10 uM | 5 hrs | Induction of cereblon-mediated aiolos degradation in human OPM2 cells at 0.1 to 10 uM after 5 hrs by immunoblot analysis | 28425720 | |
| DF15 | Function assay | 0.1 to 10 uM | 5 hrs | Induction of cereblon-mediated ikaros degradation in human DF15 cells at 0.1 to 10 uM after 5 hrs by immunoblot analysis | 28425720 | |
| OPM2 | Function assay | 0.1 to 10 uM | 5 hrs | Induction of cereblon-mediated ikaros degradation in human OPM2 cells at 0.1 to 10 uM after 5 hrs by immunoblot analysis | 28425720 | |
| EC9706 | Antiproliferative assay | 150 ug/mL | 48 hrs | Antiproliferative activity against human EC9706 cells at 150 ug/mL after 48 hrs by CCK-8 assay | 28757066 | |
| Klicken Sie hier, um weitere experimentelle Daten zu Zelllinien anzuzeigen | ||||||
Chemische Informationen, Lagerung & Stabilität
| Molekulargewicht | 259.26 | Formel | C13H13N3O3 |
Lagerung (Ab dem Eingangsdatum) | |
|---|---|---|---|---|---|
| CAS-Nr. | 191732-72-6 | SDF herunterladen | Lagerung von Stammlösungen |
|
|
| Synonyme | CC-5013 | Smiles | C1CC(=O)NC(=O)C1N2CC3=C(C2=O)C=CC=C3N | ||
Löslichkeit
|
In vitro |
DMSO
: 51 mg/mL
(196.71 mM)
Water : Insoluble Ethanol : Insoluble |
Molaritätsrechner
|
In vivo |
|||||
In-vivo-Formulierungsrechner (Klare Lösung)
Schritt 1: Geben Sie die untenstehenden Informationen ein (Empfohlen: Ein zusätzliches Tier zur Berücksichtigung von Verlusten während des Experiments)
Schritt 2: Geben Sie die In-vivo-Formulierung ein (Dies ist nur der Rechner, keine Formulierung. Bitte kontaktieren Sie uns zuerst, wenn es im Abschnitt "Löslichkeit" keine In-vivo-Formulierung gibt.)
Berechnungsergebnisse:
Arbeitskonzentration: mg/ml;
Methode zur Herstellung der DMSO-Stammlösung: mg Wirkstoff vorgelöst in μL DMSO ( Konzentration der Stammlösung mg/mL, Bitte kontaktieren Sie uns zuerst, wenn die Konzentration die DMSO-Löslichkeit der Wirkstoffcharge überschreitet. )
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügenμL PEG300, mischen und klären, dann hinzufügenμL Tween 80, mischen und klären, dann hinzufügen μL ddH2O, mischen und klären.
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügen μL Maisöl, mischen und klären.
Hinweis: 1. Bitte stellen Sie sicher, dass die Flüssigkeit klar ist, bevor Sie das nächste Lösungsmittel hinzufügen.
2. Achten Sie darauf, das/die Lösungsmittel der Reihe nach hinzuzufügen. Sie müssen sicherstellen, dass die bei der vorherigen Zugabe erhaltene Lösung eine klare Lösung ist, bevor Sie mit der Zugabe des nächsten Lösungsmittels fortfahren. Physikalische Methoden wie Vortex, Ultraschall oder ein heißes Wasserbad können zur Unterstützung des Lösens verwendet werden.
Wirkmechanismus
| Targets/IC50/Ki |
CRBN
VEGF
TNF-α
(PBMCs) 13 nM
|
|---|---|
| In vitro |
Lenalidomid induziert stark die Produktion von IL-2 und sIL-2R. Diese durch die Verbindung induzierte Tyrosinphosphorylierung von CD28 auf T-Zellen wird von einer nachgeschalteten Aktivierung von NF-κB gefolgt. Diese Verbindung und Pomalidomid hemmen die Autoubiquitinierung von CRBN in HEK293-T-Zellen, die thalidomidbindungsfähiges Wildtyp-CRBN exprimieren, aber nicht thalidomidbindungsdefektes CRBN(YW/AA). Die Überexpression von CRBN-Wildtyp-Protein, aber nicht von CRBN(YW/AA)-Mutantenprotein, in KMS12-Myelomzellen verstärkt Pomalidomid-vermittelte Reduktionen der c-myc- und IRF4-Expression und Erhöhungen der p21(WAF-1)-Expression. Die Langzeitselektion auf diese Verbindungsresistenz in H929-Myelomzelllinien geht mit einer Reduktion von CRBN einher, während in DF15R-Myelomzellen, die sowohl gegen Pomalidomid als auch gegen diese Chemikalie resistent sind, CRBN-Protein nicht nachweisbar ist. Diese Chemikalie verhindert die Induktion von Defekten durch Herunterregulierung der Expression von Tumorzell-Inhibitor-Molekülen. Sie verhindert die Induktion von Tumor-induzierter T-Zell-lytischer Synapsendysfunktion. Die Behandlung mit dieser Verbindung blockiert die CLL-Zell-induzierte T-Zell-Aktin-Synapsendysfunktion, imitiert die Antikörperblockade und reguliert die Expression von CLL-inhibitorischen Liganden und deren Rezeptoren auf T-Zellen herunter. Diese Behandlung verhindert die Tumor-induzierte Immunsuppression bei FL, DLBCL, HL, MM, SCC und OC und reguliert die immunsuppressive Ligandenexpression auf allen untersuchten Tumorzellen herunter. Die CTL-Abtötungsfunktion nimmt nach Antikörperblockade von CLL-inhibitorischen Liganden oder dieser chemischen Behandlung im Vergleich zu Kontrollbehandlungen signifikant zu. Die Behandlung von autologen CLL-T-Zell-Kokulturen mit diesem Agens kehrt die beeinträchtigte CD8+ T-Zell-lytische Synapsenbildung und Granzym B-Trafficking um. |
| Kinase-Assay |
Assay zur Hemmung der TNF-Synthese durch menschliche PBMCs
|
|
Menschliche PBMCs von normalen Spendern werden durch Ficoll-Hypaque-Dichtezentrifugation gewonnen. Zellen (106 Zellen/mL) werden in RPMI kultiviert, ergänzt mit 10 % AB+-Serum, 2 mM L-Glutamin, 100 U/mL Penicillin und 100 μg/mL Streptomycin. Lenalidomid wird in DMSO zu 20 mg/mL gelöst; weitere Verdünnungen erfolgen mit Kulturmedium. Die endgültige DMSO-Konzentration in allen Assays, einschließlich der Kontrollen, beträgt 0,25 %. Diese Verbindung wird den Zellen 1 Stunde vor der Zugabe von LPS zugesetzt. PBMCs (106 Zellen/mL) werden mit 1 μg/mL LPS von Salmonella minnesota R595 stimuliert. Zellen werden in dreifacher Ausfertigung 18–20 Stunden bei 37 °C in 5 % CO2 mit LPS inkubiert. Die Überstände werden dann geerntet und auf Zytokinspiegel getestet. In einigen Experimenten werden die Überstände bis zur Verwendung bei –70 °C eingefroren. Die Zellviabilität wird mittels Trypanblau-Ausschlussfärbemethode bestimmt. Die Konzentration von TNFα in den Kulturüberständen wird mittels ELISA bestimmt. Diese Chemikalie wird in mindestens drei separaten Experimenten getestet. Die prozentuale Hemmung wird als 100 × [1 – (Zytokin (experimentell)/Zytokin (Kontrolle))] bestimmt.
|
|
| In vivo |
Die Induktion der Angiogenese durch bFGF wird durch die orale Behandlung mit Lenalidomid dosisabhängig signifikant gehemmt. Diese Verbindung verringert den Prozentsatz der vaskularisierten Fläche signifikant von 5,16 % (Kontrollgruppe) auf 2,58 % (50 mg/kg). Sie reduziert die berechnete Gesamt-MVL signifikant von 21,07 (Kontrolle) auf 8,11 (50 mg/kg). Diese Chemikalie hemmt die HUVEC-Migration durch die Fibronectin-beschichteten Membranen in Richtung von 0,1 ng/mL bFGF bei 100 μM, 1 ng/mL VEGF bei Konzentrationen von 10 μM und 100 μM signifikant. |
Literatur |
|
Anwendungen
| Methoden | Biomarker | Bilder | PMID |
|---|---|---|---|
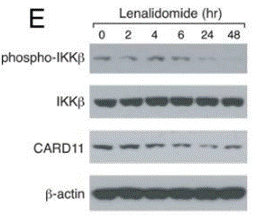
| Western blot | phospho-IKKβ / IKKβ MDM2 / p-MDM2 / p-p53 / p53 |
|
22698399 |
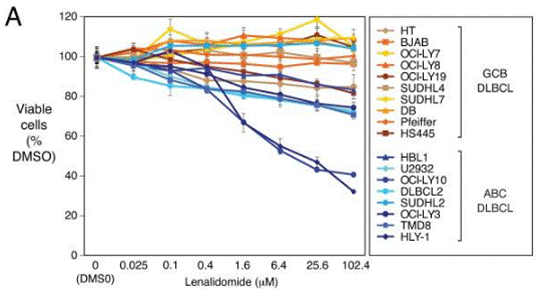
| Growth inhibition assay | Cell viability |
|
22698399 |
Klinische Studieninformationen
(Daten von https://clinicaltrials.gov, aktualisiert am 2024-05-22)
| NCT-Nummer | Rekrutierung | Erkrankungen | Sponsor/Kooperationspartner | Startdatum | Phasen |
|---|---|---|---|---|---|
| NCT06177028 | Not yet recruiting | Cognitive Impairment Mild|Cognitive Dysfunction|Amyloid Plaque|Neurodegenerative Disease Hereditary|Inflammation Brain |
St. Joseph''s Hospital and Medical Center Phoenix|Texas Tech University |
January 2 2024 | Phase 2 |
| NCT06149286 | Recruiting | Relapsed/Refractory Follicular Lymphoma|Marginal Zone Lymphoma (MZL) |
Regeneron Pharmaceuticals |
December 28 2023 | Phase 3 |
| NCT06299553 | Recruiting | DLBCL - Diffuse Large B Cell Lymphoma |
Incyte Biosciences Italy S.r.l |
December 4 2023 | -- |
Technischer Support
Tel: +1-832-582-8158 Ext:3
Wenn Sie weitere Fragen haben, hinterlassen Sie bitte eine Nachricht.
Häufig gestellte Fragen
Frage 1:
What is the formulation for its injection (i.p.) in mice?
Antwort:
This paper has the information you need: http://link.springer.com/article/10.1208/s12248-012-9401-2. Add it to the appropriate volume of sterile phosphate-buffered saline (PBS) containing 1% hydrochloric acid (HCl). The pH of this preparation was adjusted to 7.0–7.6 using sodium hydroxide and sterile filtered using a 0.22 μm Steriflip filter.
Frage 2:
what is the procedure to resuspend it?
Antwort:
This compound can be resuspended by DMSO, with a solubility of about 52 mg/mL (200.57 mM). For in vivo study, the working solution can be prepared with the vehicle of: 30% PEG400/0.5% Tween80/5% propylene glycol for oral administration.
