nur für Forschungszwecke
Telbivudine Reverse Transcriptase Inhibitor
Kat.-Nr.S1651
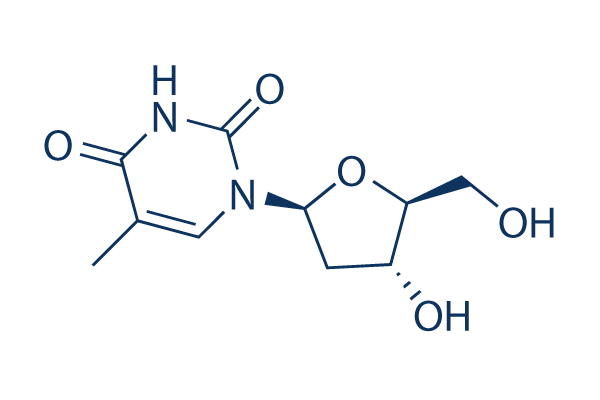
Chemische Struktur
Molekulargewicht: 242.23
Qualitätskontrolle
| Verwandte Ziele | Integrase Bacterial Antibiotics Anti-infection Fungal Antiviral COVID-19 Parasite HIV HCV Protease |
|---|---|
| Weitere Reverse Transcriptase Inhibitoren | Dapivirine (TMC120) Fangchinoline Salicylanilide 3'-Fluoro-3'-deoxythymidine (Alovudine) Ulonivirine Lersivirine (UK-453061) Bifendate 4-Chloro-2-(trifluoroacetyl)aniline hydrochloride |
Chemische Informationen, Lagerung & Stabilität
| Molekulargewicht | 242.23 | Formel | C10H14N2O5 |
Lagerung (Ab dem Eingangsdatum) | |
|---|---|---|---|---|---|
| CAS-Nr. | 3424-98-4 | SDF herunterladen | Lagerung von Stammlösungen |
|
|
| Synonyme | NV 02B | Smiles | CC1=CN(C(=O)NC1=O)C2CC(C(O2)CO)O | ||
Löslichkeit
|
In vitro |
DMSO
: 48 mg/mL
(198.15 mM)
Water : 48 mg/mL Ethanol : 2 mg/mL |
Molaritätsrechner
|
In vivo |
|||||
In-vivo-Formulierungsrechner (Klare Lösung)
Schritt 1: Geben Sie die untenstehenden Informationen ein (Empfohlen: Ein zusätzliches Tier zur Berücksichtigung von Verlusten während des Experiments)
Schritt 2: Geben Sie die In-vivo-Formulierung ein (Dies ist nur der Rechner, keine Formulierung. Bitte kontaktieren Sie uns zuerst, wenn es im Abschnitt "Löslichkeit" keine In-vivo-Formulierung gibt.)
Berechnungsergebnisse:
Arbeitskonzentration: mg/ml;
Methode zur Herstellung der DMSO-Stammlösung: mg Wirkstoff vorgelöst in μL DMSO ( Konzentration der Stammlösung mg/mL, Bitte kontaktieren Sie uns zuerst, wenn die Konzentration die DMSO-Löslichkeit der Wirkstoffcharge überschreitet. )
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügenμL PEG300, mischen und klären, dann hinzufügenμL Tween 80, mischen und klären, dann hinzufügen μL ddH2O, mischen und klären.
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügen μL Maisöl, mischen und klären.
Hinweis: 1. Bitte stellen Sie sicher, dass die Flüssigkeit klar ist, bevor Sie das nächste Lösungsmittel hinzufügen.
2. Achten Sie darauf, das/die Lösungsmittel der Reihe nach hinzuzufügen. Sie müssen sicherstellen, dass die bei der vorherigen Zugabe erhaltene Lösung eine klare Lösung ist, bevor Sie mit der Zugabe des nächsten Lösungsmittels fortfahren. Physikalische Methoden wie Vortex, Ultraschall oder ein heißes Wasserbad können zur Unterstützung des Lösens verwendet werden.
Wirkmechanismus
| Targets/IC50/Ki |
HBV RT
|
|---|---|
| In vitro |
Telbivudine zeigt eine potente, selektive und spezifische antivirale Aktivität gegen HBV und andere Hepadnaviren. Diese Verbindung wird durch intrazelluläre Thymidinkinasen zur aktiven Triphosphat-Form phosphoryliert, die eine intrazelluläre Halbwertszeit von 14 Stunden aufweist. Sein 5'-Triphosphat hemmt die HBV-DNA-Polymerase (reverse transcriptase) durch Konkurrenz mit dem natürlichen Substrat dTTP. Diese Chemikalie erhöht signifikant die Produktion von Tumornekrosefaktor-alpha und Interleukin-12 in MHV-3-induzierten Makrophagen. Sie erhöht signifikant die Serumspiegel von Interferon-gamma. Diese Behandlung verbessert die Fähigkeit von T-Zellen, Proliferation zu durchlaufen und Zytokine abzusondern, beeinflusst aber nicht die Zytotoxizität infizierter Hepatozyten. Sie unterdrückt die Expression von programmiertem Todesliganden 1 auf T-Zellen. Die Verbindung bleibt aktiv, wie die jeweiligen Fold-Changes von 0,5 (N236T) und 1,0 (A181V und A194T) zeigen. Sie ist nicht aktiv gegen HBV-Stämme mit Lamivudin-Mutationen L180M/M204V/I, bleibt aber in vitro gegen die M204V-Einzelmutante aktiv, was möglicherweise den Unterschied in den Resistenzprofilen zwischen Telbivudine und Lamivudin erklärt. |
Literatur |
|
Klinische Studieninformationen
(Daten von https://clinicaltrials.gov, aktualisiert am 2024-05-22)
| NCT-Nummer | Rekrutierung | Erkrankungen | Sponsor/Kooperationspartner | Startdatum | Phasen |
|---|---|---|---|---|---|
| NCT02956850 | Completed | Hepatitis B Chronic |
Hoffmann-La Roche |
December 12 2016 | Phase 1 |
| NCT02894554 | Terminated | HBsAg-positive Renal Allograft Recipients |
National Taiwan University Hospital |
July 2014 | Phase 4 |
| NCT01379508 | Completed | Chronic Hepatitis B |
Novartis Pharmaceuticals|Novartis |
March 21 2011 | Phase 4 |
| NCT01163240 | Completed | Liver Diseases|Hepatitis Chronic|Hepatitis Viral Human|Hepatitis|Virus Diseases|Digestive System Diseases|Hepatitis B Chronic|Hepatitis B|DNA Virus Infections |
Novartis Pharmaceuticals|Novartis |
June 2009 | -- |
| NCT00877149 | Completed | Compensated Chronic Hepatitis B |
Novartis Pharmaceuticals|Novartis |
March 2009 | Phase 4 |
Technischer Support
Tel: +1-832-582-8158 Ext:3
Wenn Sie weitere Fragen haben, hinterlassen Sie bitte eine Nachricht.
