nur für Forschungszwecke
Lixisenatide Glucagon Receptor Agonist
Kat.-Nr.S8517
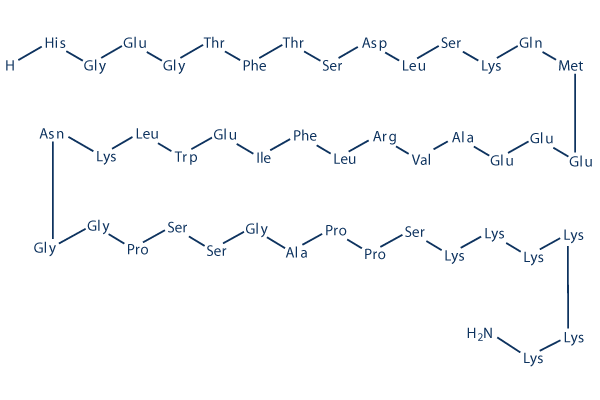
Chemische Struktur
Molekulargewicht: 4858.49
Qualitätskontrolle
| Verwandte Ziele | CXCR Hedgehog/Smoothened PKA Adrenergic Receptor AChR 5-HT Receptor Histamine Receptor Dopamine Receptor Ras KRas |
|---|---|
| Weitere Glucagon Receptor Inhibitoren | Orforglipron (LY3502970) Relacorilant (CORT125134) Avexitide Exendin-4 Shanzhiside methyl ester Adomeglivant Apraglutide (FE 203799) GLP-1 (7-37) V-0219 Retatrutide |
Chemische Informationen, Lagerung & Stabilität
| Molekulargewicht | 4858.49 | Formel | C215H347N61O65S |
Lagerung (Ab dem Eingangsdatum) | |
|---|---|---|---|---|---|
| CAS-Nr. | 320367-13-3 | SDF herunterladen | Lagerung von Stammlösungen |
|
|
| Synonyme | Lyxumia, Adlyxin, ZP10A peptide, AVE0010 | Smiles | CCC(C)C(C(=O)NC(CCC(=O)O)C(=O)NC(CC1=CNC2=CC=CC=C21)C(=O)NC(CC(C)C)C(=O)NC(CCCCN)C(=O)NC(CC(=O)N)C(=O)NCC(=O)NCC(=O)N3CCCC3C(=O)NC(CO)C(=O)NC(CO)C(=O)NCC(=O)NC(C)C(=O)N4CCCC4C(=O)N5CCCC5C(=O)NC(CO)C(=O)NC(CCCCN)C(=O)NC(CCCCN)C(=O)NC(CCCCN)C(=O)NC(CCCCN)C(=O)NC(CCCCN)C(=O)NC(CCCCN)C(=O)N)NC(=O)C(CC6=CC=CC=C6)NC(=O)C(CC(C)C)NC(=O)C(CCCNC(=N)N)NC(=O)C(C(C)C)NC(=O)C(C)NC(=O)C(CCC(=O)O)NC(=O)C(CCC(=O)O)NC(=O)C(CCC(=O)O)NC(=O)C(CCSC)NC(=O)C(CCC(=O)N)NC(=O)C(CCCCN)NC(=O)C(CO)NC(=O)C(CC(C)C)NC(=O)C(CC(=O)O)NC(=O)C(CO)NC(=O)C(C(C)O)NC(=O)C(CC7=CC=CC=C7)NC(=O)C(C(C)O)NC(=O)CNC(=O)C(CCC(=O)O)NC(=O)CNC(=O)C(CC8=CNC=N8)N | ||
Löslichkeit
|
In vitro |
Water : 100 mg/mL |
Molaritätsrechner
|
In vivo |
|||||
In-vivo-Formulierungsrechner (Klare Lösung)
Schritt 1: Geben Sie die untenstehenden Informationen ein (Empfohlen: Ein zusätzliches Tier zur Berücksichtigung von Verlusten während des Experiments)
Schritt 2: Geben Sie die In-vivo-Formulierung ein (Dies ist nur der Rechner, keine Formulierung. Bitte kontaktieren Sie uns zuerst, wenn es im Abschnitt "Löslichkeit" keine In-vivo-Formulierung gibt.)
Berechnungsergebnisse:
Arbeitskonzentration: mg/ml;
Methode zur Herstellung der DMSO-Stammlösung: mg Wirkstoff vorgelöst in μL DMSO ( Konzentration der Stammlösung mg/mL, Bitte kontaktieren Sie uns zuerst, wenn die Konzentration die DMSO-Löslichkeit der Wirkstoffcharge überschreitet. )
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügenμL PEG300, mischen und klären, dann hinzufügenμL Tween 80, mischen und klären, dann hinzufügen μL ddH2O, mischen und klären.
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügen μL Maisöl, mischen und klären.
Hinweis: 1. Bitte stellen Sie sicher, dass die Flüssigkeit klar ist, bevor Sie das nächste Lösungsmittel hinzufügen.
2. Achten Sie darauf, das/die Lösungsmittel der Reihe nach hinzuzufügen. Sie müssen sicherstellen, dass die bei der vorherigen Zugabe erhaltene Lösung eine klare Lösung ist, bevor Sie mit der Zugabe des nächsten Lösungsmittels fortfahren. Physikalische Methoden wie Vortex, Ultraschall oder ein heißes Wasserbad können zur Unterstützung des Lösens verwendet werden.
Wirkmechanismus
| Targets/IC50/Ki |
GLP-1R
(Cell-free assay) 1.4 nM
|
|---|---|
| In vitro |
Lixisenatide schützt Ins-1-Zellen (eine von Ratten stammende β-Zelllinie) sowohl vor Lipid- als auch vor Zytokin-induzierter Apoptose. Noch wichtiger ist, dass diese Verbindung auch die Lipotoxizität-induzierte Insulinverarmung in menschlichen Inseln verhindert und die Insulinproduktion, -speicherung und die Funktion der Pankreas-β-Zellen in vitro erhält. Bindungsstudien in CHO-K1-Zellen, die den menschlichen GLP-1-Rezeptor überexprimieren, zeigen, dass es ein sehr potenter und selektiver GLP-1-Rezeptor-Agonist ist – die Bindungsaffinität dieser Chemikalie (Ki = 1,33 ± 0,22 nM) ist ca. 4-mal größer als die des menschlichen GLP-1 (Ki = 5,09 ± 1,19 nM). In mehr als 80 verschiedenen Bindungstests zeigt es keine relevante Interaktion mit anderen potenziellen Medikamentenzielen, was seine hohe Selektivität für den GLP-1-Rezeptor bestätigt.
|
| In vivo |
Die Halbwertszeit von Lixisenatide beträgt 2-4 Stunden, und es wird als kurzwirksamer GLP-1-Rezeptor-Agonist eingestuft, im Vergleich zu den langwirksamen GLP-1-basierten Peptiden Liraglutid und Albiglutid. Diese Verbindung kann die Glukose-stimulierte Insulinsekretion signifikant verbessern. Bei gesunden normoglykämischen Hunden führen einzelne subkutane Injektionen dieses Wirkstoffs zu dosisabhängigen Reduktionen des Plasmaglukosespiegels nach einer oralen Glukosebelastung und reduzieren postprandiale Glukoseexkursionen signifikant um 67% im Vergleich zu Placebo, ohne die Insulinkonzentrationen zu erhöhen. Der Effekt dieses Peptids auf postprandiale Blutglukoseexkursionen bei Hunden ist zumindest teilweise auf die Hemmung der Magenentleerung und die verzögerte intestinale Glukoseabsorption zurückzuführen. Dosisabhängige Reduktionen des Plasmaglukosespiegels nach einer oralen Glukosebelastung wurden auch bei db/db-Mäusen und ZDF-Ratten nachgewiesen. Wichtig ist, dass diese Aktivität glukoseabhängig ist und bei physiologischen Glukosekonzentrationen keine Wirkung zeigt. Bei db/db-Mäusen verhindert die chronische Verabreichung dieser Verbindung die fortschreitende Verschlechterung der Glukosetoleranz, die bei Kontrolltieren beobachtet wird, und ist mit signifikanten dosisabhängigen Reduktionen des glykosylierten Hämoglobins (HbA1c) verbunden. Bei ZDF-Ratten verringert eine kontinuierliche subkutane Infusion dieses Wirkstoffs von 50 μg/kg/Tag über 12 Wochen den basalen Blutglukosespiegel signifikant und verbessert die orale Glukosetoleranz im Vergleich zu Kontrolltieren. Es hat keine hypoglykämische Wirkung und verändert den HbA1c-Wert bei normoglykämischen Ratten nicht. Diese Chemikalie kann die Betazellmasse und -funktion durch Stimulation der Inselzellproliferation und Neogenese sowie Hemmung der Inselzellapoptose aufrechterhalten. Sie erhält die Pankreasreagibilität bei diabetischen Tieren.
|
Literatur |
|
Klinische Studieninformationen
(Daten von https://clinicaltrials.gov, aktualisiert am 2024-05-22)
| NCT-Nummer | Rekrutierung | Erkrankungen | Sponsor/Kooperationspartner | Startdatum | Phasen |
|---|---|---|---|---|---|
| NCT02274740 | Terminated | Type II Diabetes Mellitus |
Sanofi |
April 2015 | Phase 2 |
Technischer Support
Tel: +1-832-582-8158 Ext:3
Wenn Sie weitere Fragen haben, hinterlassen Sie bitte eine Nachricht.
