nur für Forschungszwecke
MRS 2578 P2 Receptor Hemmer
Kat.-Nr.S2855
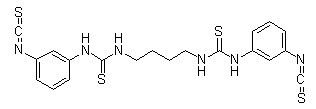
Chemische Struktur
Molekulargewicht: 472.67
Qualitätskontrolle
- In Nature Medicine für seine erstklassige Qualität zitiert
- COA
- NMR
- HPLC
- SDS
- Datenblatt
| Verwandte Ziele | Adrenergic Receptor AChR 5-HT Receptor COX Calcium Channel Histamine Receptor Dopamine Receptor GABA Receptor TRP Channel Cholinesterase (ChE) |
|---|---|
| Weitere P2 Receptor Inhibitoren | A-438079 Hydrochloride A-804598 A-740003 5-BDBD Gefapixant AF-353 A-317491 Minodronic acid Diquafosol Tetrasodium BX430 |
Chemische Informationen, Lagerung & Stabilität
| Molekulargewicht | 472.67 | Formel | C20H20N6S4 |
Lagerung (Ab dem Eingangsdatum) | |
|---|---|---|---|---|---|
| CAS-Nr. | 711019-86-2 | SDF herunterladen | Lagerung von Stammlösungen |
|
|
| Synonyme | N/A | Smiles | C1=CC(=CC(=C1)N=C=S)NC(=S)NCCCCNC(=S)NC2=CC(=CC=C2)N=C=S | ||
Löslichkeit
|
In vitro |
DMSO
: 42 mg/mL
(88.85 mM)
Water : Insoluble Ethanol : Insoluble |
Molaritätsrechner
|
In vivo |
|||||
In-vivo-Formulierungsrechner (Klare Lösung)
Schritt 1: Geben Sie die untenstehenden Informationen ein (Empfohlen: Ein zusätzliches Tier zur Berücksichtigung von Verlusten während des Experiments)
Schritt 2: Geben Sie die In-vivo-Formulierung ein (Dies ist nur der Rechner, keine Formulierung. Bitte kontaktieren Sie uns zuerst, wenn es im Abschnitt "Löslichkeit" keine In-vivo-Formulierung gibt.)
Berechnungsergebnisse:
Arbeitskonzentration: mg/ml;
Methode zur Herstellung der DMSO-Stammlösung: mg Wirkstoff vorgelöst in μL DMSO ( Konzentration der Stammlösung mg/mL, Bitte kontaktieren Sie uns zuerst, wenn die Konzentration die DMSO-Löslichkeit der Wirkstoffcharge überschreitet. )
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügenμL PEG300, mischen und klären, dann hinzufügenμL Tween 80, mischen und klären, dann hinzufügen μL ddH2O, mischen und klären.
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügen μL Maisöl, mischen und klären.
Hinweis: 1. Bitte stellen Sie sicher, dass die Flüssigkeit klar ist, bevor Sie das nächste Lösungsmittel hinzufügen.
2. Achten Sie darauf, das/die Lösungsmittel der Reihe nach hinzuzufügen. Sie müssen sicherstellen, dass die bei der vorherigen Zugabe erhaltene Lösung eine klare Lösung ist, bevor Sie mit der Zugabe des nächsten Lösungsmittels fortfahren. Physikalische Methoden wie Vortex, Ultraschall oder ein heißes Wasserbad können zur Unterstützung des Lösens verwendet werden.
Wirkmechanismus
| Targets/IC50/Ki |
P2Y6
37 nM
|
|---|---|
| In vitro |
MRS2578 blockiert selektiv die P2Y6-Rezeptoraktivität gegenüber der Aktivität an P2Y1-, P2Y2-, P2Y4- oder P2Y11-Rezeptoren. Diese Verbindung (1 μM) blockiert vollständig den Schutz durch UDP, das sich einer TNFalpha-induzierten Apoptose in 1321N1-Astrozytomzellen unterzieht. Es hemmt die basale NF-κB-Aktivität zeit- und dosisabhängig in HMEC-1-Zellen, die mit 0,25 μg NF-κB-Promotorreporter transfiziert wurden. Diese Chemikalie (10 μM) hebt die TNF-α-induzierte NF-κB-Reporteraktivität in HMEC-1-Zellen vollständig auf. Es (10 μM) reduziert die TNF-α-induzierte proinflammatorische Genexpression in HMEC-1-Zellen signifikant. Die Verbindung potenziert die ATPγS- und UDP-Reaktion bei Konzentrationen unter 316 nM, während sie oberhalb dieser Konzentration die ATPS- und UDP-induzierte IP-Akkumulation in Myofibroblasten des neonatalen Rattenherzens hemmt. Mit MRS2578 behandelte Mäuse zeigen eine reduzierte bronchiale Hyperreagibilität gegenüber Methacholin bei OVA-sensibilisierten Mäusen. Diese Verbindung blockiert vollständig die UDP-induzierte Freisetzung von IL-6, KC und IL-8 in Lungenepithelzellen.
|
| In vivo |
MRS 2578 (10 μM) reduziert die Keratinozyten-abgeleiteten Chemokin-Serumproteinspiegel bei LPS-induzierter vaskulärer Entzündung in C57BL/6-Mäusen. Diese Verbindung (10 μM, intratracheal) reduziert die BALF-Eosinophilie und die Spiegel von IL-5 und IL-13 in der BALF bei OVA-sensibilisierten Mäusen und führt zu einer deutlich abgeschwächten Veränderung der Methacholin-Reagibilität nach OVA-Exposition. Diese Verbindung (10 μM, intratracheal) hemmt die durch Hausstaubmilben induzierte allergische Atemwegsentzündung bei OVA-sensibilisierten Mäusen. Diese Verbindung (10 μM, intratracheal) reduziert die IL-6- und KC-Spiegel in der BALF bei OVA-sensibilisierten Mäusen.
|
Literatur |
|
Technischer Support
Tel: +1-832-582-8158 Ext:3
Wenn Sie weitere Fragen haben, hinterlassen Sie bitte eine Nachricht.
