nur für Forschungszwecke
NH125 CaMK Inhibitor
Kat.-Nr.S7436
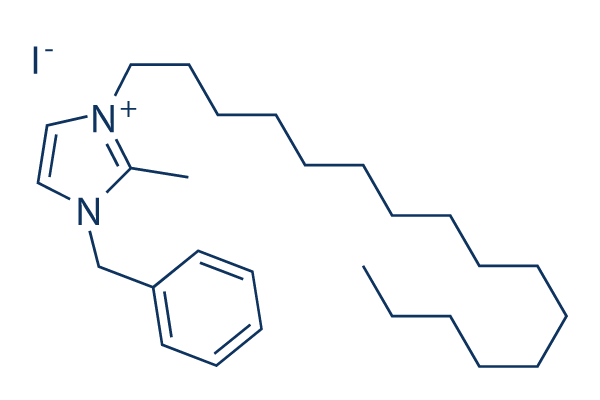
Chemische Struktur
Molekulargewicht: 524.56
Qualitätskontrolle
- In Nature Medicine für seine erstklassige Qualität zitiert
- COA
- NMR
- SDS
- Datenblatt
| Verwandte Ziele | Adrenergic Receptor AChR 5-HT Receptor COX Calcium Channel Histamine Receptor Dopamine Receptor GABA Receptor TRP Channel Cholinesterase (ChE) |
|---|---|
| Weitere CaMK Inhibitoren | KN-93 Phosphate KN-93 STO-609 KN-62 KN-92 phosphate KN-93 hydrochloride |
Chemische Informationen, Lagerung & Stabilität
| Molekulargewicht | 524.56 | Formel | C27H45IN2 |
Lagerung (Ab dem Eingangsdatum) | |
|---|---|---|---|---|---|
| CAS-Nr. | 278603-08-0 | SDF herunterladen | Lagerung von Stammlösungen |
|
|
| Synonyme | N/A | Smiles | CCCCCCCCCCCCCCCCN1C=C[N+](=C1C)CC2=CC=CC=C2.[I-] | ||
Löslichkeit
|
In vitro |
DMSO
: 100 mg/mL
(190.63 mM)
Ethanol : 100 mg/mL Water : Insoluble |
Molaritätsrechner
|
In vivo |
|||||
In-vivo-Formulierungsrechner (Klare Lösung)
Schritt 1: Geben Sie die untenstehenden Informationen ein (Empfohlen: Ein zusätzliches Tier zur Berücksichtigung von Verlusten während des Experiments)
Schritt 2: Geben Sie die In-vivo-Formulierung ein (Dies ist nur der Rechner, keine Formulierung. Bitte kontaktieren Sie uns zuerst, wenn es im Abschnitt "Löslichkeit" keine In-vivo-Formulierung gibt.)
Berechnungsergebnisse:
Arbeitskonzentration: mg/ml;
Methode zur Herstellung der DMSO-Stammlösung: mg Wirkstoff vorgelöst in μL DMSO ( Konzentration der Stammlösung mg/mL, Bitte kontaktieren Sie uns zuerst, wenn die Konzentration die DMSO-Löslichkeit der Wirkstoffcharge überschreitet. )
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügenμL PEG300, mischen und klären, dann hinzufügenμL Tween 80, mischen und klären, dann hinzufügen μL ddH2O, mischen und klären.
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügen μL Maisöl, mischen und klären.
Hinweis: 1. Bitte stellen Sie sicher, dass die Flüssigkeit klar ist, bevor Sie das nächste Lösungsmittel hinzufügen.
2. Achten Sie darauf, das/die Lösungsmittel der Reihe nach hinzuzufügen. Sie müssen sicherstellen, dass die bei der vorherigen Zugabe erhaltene Lösung eine klare Lösung ist, bevor Sie mit der Zugabe des nächsten Lösungsmittels fortfahren. Physikalische Methoden wie Vortex, Ultraschall oder ein heißes Wasserbad können zur Unterstützung des Lösens verwendet werden.
Wirkmechanismus
| Targets/IC50/Ki |
eEF-2 kinase
60 nM
|
|---|---|
| In vitro |
In C6-Gliomzellen verringert NH125 den zellulären Gehalt an Phospho-eEF-2, ohne den Gesamtgehalt an eEF-2 zu beeinflussen, und blockiert den Zellzyklusübergang an der G1-S-Grenze. Diese Verbindung hemmt potent die Zellviabilität von 10 Krebszellen mit einer IC50 im Bereich von 0,7 bis 4,8 μM. Sie hemmt effektiv Histidin-Proteinkinasen, einschließlich Envz, PhoQ, BvgS, EvgS, und erzeugt somit potente antibakterielle Aktivitäten gegen Oxacillin-resistenten Staphylococcus aureus (ORSA), Vancomycin-resistenten Enterococcus faecalis (VRE), Penicillin-resistenten Streptococcus pneumoniae (PRS) und andere grampositive und gramnegative Bakterien. Die Hemmung der EEF2K durch diese Chemikalie macht Tumorzellen empfindlicher gegenüber Curcumin und Velcade, die eine ER-Stress-induzierende Wirkung besitzen.
|
| Kinase-Assay |
eEF-2-Kinase-Assay
|
|
Die eEF-2-Kinase-Aktivität wird mit zwei Methoden gemessen: (a) einem filterbasierten Assay; und (b) mittels Immunoblotting unter Verwendung eines Antiphospho-eEF2-Antikörpers. Für beide werden Reaktionen in einem Gesamtvolumen von 20 μl durchgeführt, das 50 mM HEPES (pH 7,5), 10 mM MgCl2, 1,5 mM CaCl2, 100 μg/ml Calmodulin, 2 μM His-markiertes eEF-2 und 400 nM GST-eEF-2-Kinase sowie ATP-Mischung [50 μM ATP mit 1μCi (γ-33P)ATP] enthält. Die Kinase-Mischung ohne ATP wird auf Eis vorbereitet und dann 15 Minuten bei Raumtemperatur vorinkubiert. Kinase-Reaktionen werden durch Zugabe von ATP gestartet und 30 Minuten bei 30 °C ablaufen gelassen. Für den filterbasierten Assay wird die Reaktion durch Zugabe von 20 μl kalter 1,5%iger Phosphorsäure beendet, und 5 μl der Reaktion werden auf P81 Whatman Phosphocellulosepapier aufgetragen. Das Papier wird dreimal in 500 ml 0,5%iger Phosphorsäure und einmal mit 200 ml Aceton gewaschen. Das Papier wird dann luftgetrocknet und in 10 ml Szintillationsmischung getaucht. Die Radioaktivität wird mit einem Beckton-Dickinson Flüssigszintillationszähler gezählt. Für das Immunoblotting werden die Reaktionen durch Zugabe von 20 μl 3× Lamelli-Puffer [190 mM Tris (pH 6,8), 6% SDS, 30% Glycerin, 15% 2-Mercaptoethanol und 0,003% Bromphenolblau-Farbstoff] gestoppt. Proben werden 5 Minuten gekocht und mittels 7%iger SDS-PAGE aufgetrennt und wie unten beschrieben für das Western Blotting verarbeitet. Die Bedingungen für beide Assays werden so gewählt, dass die Linearität der Reaktion in Bezug auf die Inkubationszeit und die Enzymkonzentration gewährleistet ist.
|
|
| In vivo |
NH125 reduziert den Blutdruck bei SHR und die ROS-Produktion, die Induktion entzündlicher Moleküle und die Hypertrophie in der Arteria mesenterica superior von SHR.
|
Literatur |
|
Technischer Support
Tel: +1-832-582-8158 Ext:3
Wenn Sie weitere Fragen haben, hinterlassen Sie bitte eine Nachricht.
