nur für Forschungszwecke
Ticarcillin sodium Selection Antibiotics for Transfected Cell Inhibitor
Kat.-Nr.S3193
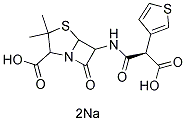
Chemische Struktur
Molekulargewicht: 430.41
Qualitätskontrolle
| Verwandte Ziele | Integrase Bacterial Antibiotics Anti-infection Fungal Antiviral COVID-19 Parasite Reverse Transcriptase HIV |
|---|---|
| Weitere Selection Antibiotics for Transfected Cell Inhibitoren | Blasticidin S Hydrochloride Ribostamycin Sulfate D-Cycloserine |
Chemische Informationen, Lagerung & Stabilität
| Molekulargewicht | 430.41 | Formel | C15H16N2O6S2.2Na |
Lagerung (Ab dem Eingangsdatum) | |
|---|---|---|---|---|---|
| CAS-Nr. | 29457-07-6 | SDF herunterladen | Lagerung von Stammlösungen |
|
|
| Synonyme | AB 2288, BRL 2288 | Smiles | CC1(C(N2C(S1)C(C2=O)NC(=O)C(C3=CSC=C3)C(=O)[O-])C(=O)[O-])C.[Na+].[Na+] | ||
Löslichkeit
|
In vitro |
DMSO
: 86 mg/mL
(199.8 mM)
Water : 86 mg/mL Ethanol : Insoluble |
Molaritätsrechner
|
In vivo |
|||||
In-vivo-Formulierungsrechner (Klare Lösung)
Schritt 1: Geben Sie die untenstehenden Informationen ein (Empfohlen: Ein zusätzliches Tier zur Berücksichtigung von Verlusten während des Experiments)
Schritt 2: Geben Sie die In-vivo-Formulierung ein (Dies ist nur der Rechner, keine Formulierung. Bitte kontaktieren Sie uns zuerst, wenn es im Abschnitt "Löslichkeit" keine In-vivo-Formulierung gibt.)
Berechnungsergebnisse:
Arbeitskonzentration: mg/ml;
Methode zur Herstellung der DMSO-Stammlösung: mg Wirkstoff vorgelöst in μL DMSO ( Konzentration der Stammlösung mg/mL, Bitte kontaktieren Sie uns zuerst, wenn die Konzentration die DMSO-Löslichkeit der Wirkstoffcharge überschreitet. )
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügenμL PEG300, mischen und klären, dann hinzufügenμL Tween 80, mischen und klären, dann hinzufügen μL ddH2O, mischen und klären.
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügen μL Maisöl, mischen und klären.
Hinweis: 1. Bitte stellen Sie sicher, dass die Flüssigkeit klar ist, bevor Sie das nächste Lösungsmittel hinzufügen.
2. Achten Sie darauf, das/die Lösungsmittel der Reihe nach hinzuzufügen. Sie müssen sicherstellen, dass die bei der vorherigen Zugabe erhaltene Lösung eine klare Lösung ist, bevor Sie mit der Zugabe des nächsten Lösungsmittels fortfahren. Physikalische Methoden wie Vortex, Ultraschall oder ein heißes Wasserbad können zur Unterstützung des Lösens verwendet werden.
Wirkmechanismus
| In vitro |
Die MHKs von Ticarcillin (64 mg/mL) für 90 % aller Beta-Lactamase-positiven Stämme werden durch die Zugabe von Clavulanat auf 2 mg/mL reduziert. Die MHKs von Ticarcillin für 90 % aller Beta-Lactamase-negativen Stämme betragen 4 mg/mL. 93,4 % der Beta-Lactamase-produzierenden Stämme sind bei weniger als oder gleich 64 mg/mL empfindlich gegenüber Ticarcillin. Ticarcillin/Kaliumclavulanat ist lichtstabil und resistent gegen Inaktivierung durch β-Lactamase. Ticarcillin/Kaliumclavulanat ist wirtschaftlicher als Carbenicillin und Cefotaxim zur Eliminierung von Agrobacterium tumefaciens bei der Pflanzenzelltransformation.
|
|---|---|
| In vivo |
Die mittlere Eliminationshalbwertszeit von Ticarcillin (120 mg/kg) im Serum beträgt bei den Kontrollpersonen 70,8 Minuten und bei Patienten mit Mukoviszidose 53,1 Minuten. Die totale Körperclearance von Ticarcillin ist bei Mukoviszidose-Patienten signifikant höher (65,6 mL/min/m2 gegenüber 46,2 mL/min/m2 bei Kontrollpersonen). Die nicht-renale Clearance von Ticarcillin ist auch bei Patienten mit Mukoviszidose signifikant höher (24,8 mL/min/m2 gegenüber 13,3 mL/min/m2 für die Kontrollgruppe). Ticarcillin/Clavulanat (3,1 g, intravenös alle 4-6 Stunden verabreicht) führt zu einer klinischen Erfolgsrate von 80,3 % und einer klinischen Misserfolgsrate von 19,7 % bei der Behandlung komplizierter Haut- und Weichteilinfektionen. Die Gesamt-Eradikationsrate beträgt 83,7 % in der Ticarcillin/Clavulanat-Behandlungsgruppe in der mikrobiologisch auswertbaren Population. Ticarcillin/Clavulanat führt zu Heilungsraten von 79 % zum Zeitpunkt der abschließenden Bewertung bei der Behandlung von intraabdominellen Infektionen bei pädiatrischen und erwachsenen Patienten.
|
Literatur |
|
Klinische Studieninformationen
(Daten von https://clinicaltrials.gov, aktualisiert am 2024-05-22)
| NCT-Nummer | Rekrutierung | Erkrankungen | Sponsor/Kooperationspartner | Startdatum | Phasen |
|---|---|---|---|---|---|
| NCT01229046 | Withdrawn | Sepsis |
Phillip Brian Smith|Duke University |
September 2010 | Phase 1 |
Technischer Support
Tel: +1-832-582-8158 Ext:3
Wenn Sie weitere Fragen haben, hinterlassen Sie bitte eine Nachricht.
