nur für Forschungszwecke
LY2886721 BACE Inhibitor
Kat.-Nr.S2156
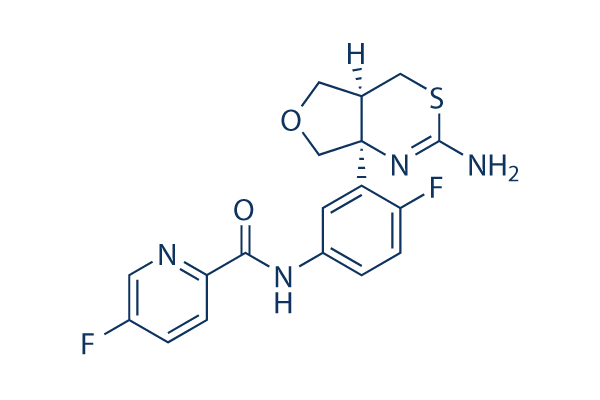
Chemische Struktur
Molekulargewicht: 390.41
Qualitätskontrolle
Chemische Informationen, Lagerung & Stabilität
| Molekulargewicht | 390.41 | Formel | C18H16F2N4O2S |
Lagerung (Ab dem Eingangsdatum) | |
|---|---|---|---|---|---|
| CAS-Nr. | 1262036-50-9 | SDF herunterladen | Lagerung von Stammlösungen |
|
|
| Synonyme | N/A | Smiles | C1C2CSC(=NC2(CO1)C3=C(C=CC(=C3)NC(=O)C4=NC=C(C=C4)F)F)N | ||
Löslichkeit
|
In vitro |
DMSO
: 35 mg/mL
(89.64 mM)
Water : Insoluble Ethanol : Insoluble |
Molaritätsrechner
|
In vivo |
|||||
In-vivo-Formulierungsrechner (Klare Lösung)
Schritt 1: Geben Sie die untenstehenden Informationen ein (Empfohlen: Ein zusätzliches Tier zur Berücksichtigung von Verlusten während des Experiments)
Schritt 2: Geben Sie die In-vivo-Formulierung ein (Dies ist nur der Rechner, keine Formulierung. Bitte kontaktieren Sie uns zuerst, wenn es im Abschnitt "Löslichkeit" keine In-vivo-Formulierung gibt.)
Berechnungsergebnisse:
Arbeitskonzentration: mg/ml;
Methode zur Herstellung der DMSO-Stammlösung: mg Wirkstoff vorgelöst in μL DMSO ( Konzentration der Stammlösung mg/mL, Bitte kontaktieren Sie uns zuerst, wenn die Konzentration die DMSO-Löslichkeit der Wirkstoffcharge überschreitet. )
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügenμL PEG300, mischen und klären, dann hinzufügenμL Tween 80, mischen und klären, dann hinzufügen μL ddH2O, mischen und klären.
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügen μL Maisöl, mischen und klären.
Hinweis: 1. Bitte stellen Sie sicher, dass die Flüssigkeit klar ist, bevor Sie das nächste Lösungsmittel hinzufügen.
2. Achten Sie darauf, das/die Lösungsmittel der Reihe nach hinzuzufügen. Sie müssen sicherstellen, dass die bei der vorherigen Zugabe erhaltene Lösung eine klare Lösung ist, bevor Sie mit der Zugabe des nächsten Lösungsmittels fortfahren. Physikalische Methoden wie Vortex, Ultraschall oder ein heißes Wasserbad können zur Unterstützung des Lösens verwendet werden.
Wirkmechanismus
| Targets/IC50/Ki |
BACE2
(Cell-free assay) 10.2 nM
BACE1
(Cell-free assay) 20.3 nM
|
|---|---|
| In vitro |
LY2886721 ist ein oral verabreichtes, niedermolekulares β-Amyloid-Protein-spaltendes Enzym (BACE)-Inhibitor mit dem Potenzial, die Synthese von β-Amyloid zu hemmen und dadurch das klinische Fortschreiten der AD zu verlangsamen. Diese Verbindung kann auch die γ-Sekretase ansteuern, um die Synthese von β-Amyloid zu hemmen. Sie hemmt rekombinante hBACE1 mit einer IC50 von 20,3 nM. In zellulären Assays hemmt diese Chemikalie Abeta mit einer IC50 von 18,7 nM bzw. 10,7 nM in HEK293Swe- und PDAPP-Neuronen-Kulturen. Sie weist eine hohe Selektivität gegenüber wichtigen Off-Target-Proteasen auf, was die In-vitro-Aktivität effizient in eine robuste In-vivo-Amyloid-β-Senkung in nicht-klinischen Tiermodellen umsetzt. Die Bewertung ihrer Aktivität gegen hBACE2 zeigt eine IC50 von 10,2 nM. Die Bewertung der Aktivität der Verbindung gegen Cathepsin D, Pepsin, Renin oder andere wichtige Aspartylproteasen zeigt im Wesentlichen keine Hemmung (IC50 >100.000 nM), was darauf hindeutet, dass eine Aktivität gegen diese gängigen Aspartylproteasen unwahrscheinlich von Bedeutung ist.
|
| In vivo |
Die orale Verabreichung von LY2886721 an PDAPP-Mäuse führt zu dosisabhängigen Reduktionen von Abeta, C99 und sAPPbeta im Gehirn. Die Abeta-Spiegel im Gehirn sind drei Stunden nach einer Dosis von 3-30 mg/kg dieser Verbindung um ca. 20%-65% im Vergleich zu Vehikel-behandelten Gruppen reduziert. Die C99- und sAPPb-Spiegel im Gehirn sind ebenfalls dosisabhängig reduziert, was mit einer BACE1-Hemmung in vivo übereinstimmt. Die pharmakodynamischen Reaktionen auf diese Chemikalie halten in den Gehirnen von PDAPP-Mäusen bis zu 9 Stunden nach der Dosis an. Pharmakodynamische Studien an Beaglehunden zeigen robuste und anhaltende Reduktionen von Plasma-Abeta nach einer Dosis von 1 mg/kg. Zentrale Effekte der BACE1-Hemmung beim Hund manifestieren sich durch eine 50%ige Reduktion von CSF-Abeta 9 Stunden nach einer Dosis von 0,5 mg/kg. Die geometrische mittlere terminale Eliminations-t1/2 wurde mit 17,2 h (Bereich 8,19-36,3 h) bestimmt. Die geometrische mittlere scheinbare orale Clearance betrug 34,8 L/h (38% CV) und das scheinbare Verteilungsvolumen während der terminalen Phase betrug 863 L (56% CV) über alle Dosisstufen. Diese Verbindung ist frei permeabel über die Blut-Hirn-Schranke.
|
Literatur |
|
Klinische Studieninformationen
(Daten von https://clinicaltrials.gov, aktualisiert am 2024-05-22)
| NCT-Nummer | Rekrutierung | Erkrankungen | Sponsor/Kooperationspartner | Startdatum | Phasen |
|---|---|---|---|---|---|
| NCT01807026 | Completed | Alzheimer Disease|Healthy Volunteers |
Eli Lilly and Company |
March 2013 | Phase 1 |
| NCT01534273 | Completed | Healthy Volunteers |
Eli Lilly and Company |
February 2012 | Phase 1 |
| NCT01367262 | Completed | Healthy Volunteers |
Eli Lilly and Company |
June 2011 | Phase 1 |
| NCT01227252 | Completed | Alzheimer''s Disease |
Eli Lilly and Company |
December 2010 | Phase 1 |
| NCT01133405 | Completed | Alzheimer''s Disease |
Eli Lilly and Company |
June 2010 | Phase 1 |
Technischer Support
Tel: +1-832-582-8158 Ext:3
Wenn Sie weitere Fragen haben, hinterlassen Sie bitte eine Nachricht.
