nur für Forschungszwecke
Tenofovir Disoproxil Fumarate Reverse Transcriptase Inhibitor
Kat.-Nr.S1400
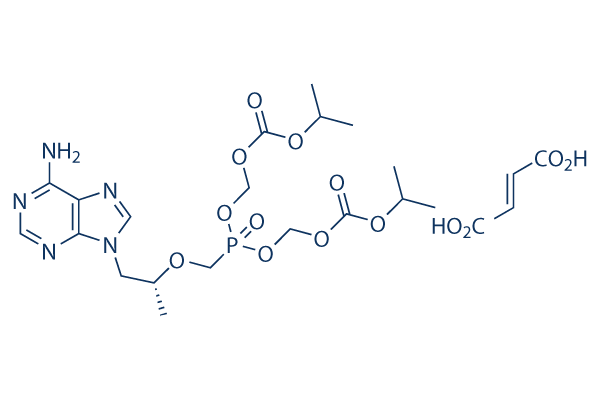
Chemische Struktur
Molekulargewicht: 635.51
Qualitätskontrolle
| Verwandte Ziele | Integrase Bacterial Antibiotics Anti-infection Fungal Antiviral COVID-19 Parasite HIV HCV Protease |
|---|---|
| Weitere Reverse Transcriptase Inhibitoren | Dapivirine (TMC120) Fangchinoline Salicylanilide 3'-Fluoro-3'-deoxythymidine (Alovudine) Ulonivirine Lersivirine (UK-453061) Bifendate 4-Chloro-2-(trifluoroacetyl)aniline hydrochloride |
Zellkultur, Behandlung & Arbeitskonzentration
| Zelllinien | Assay-Typ | Konzentration | Inkubationszeit | Formulierung | Aktivitätsbeschreibung | PMID |
|---|---|---|---|---|---|---|
| MT2 | Function assay | 5 days | Inhibition of virus-induced cytopathic effect in wild type HIV 3a infected MT2 cells after 5 days, EC50=0.015μM | 17562366 | ||
| HepG2 | Cytotoxicity assay | 9 days | Cytotoxicity against human HepG2 cells after 9 days by MTT assay, IC50=2.31μM | 17888662 | ||
| HepG2 | Antiviral assay | 9 days | Antiviral activity against Hepatitis B virus infected human HepG2 cells after 9 days by MTT assay, IC50=5.1μM | 17888662 | ||
| MT-2 | Antiviral assay | Antiviral activity against HIV1 3B infected in human MT-2 cells by two fold dilution method in presence of 10% FBS, EC50=0.0068μM | 19104010 | |||
| MT2 | Antiviral assay | Antiviral activity against HIV1 infected in human MT2 cells assessed as inhibition of viral replication, IC50=0.54μM | 19596885 | |||
| HeLa P4/R5 | Antiviral assay | Antiviral activity against HIV1 infected in human HeLa P4/R5 cells assessed as inhibition of viral replication, IC50=4.7μM | 19596885 | |||
| HeLa P4/R5 | Antiviral assay | Antiviral activity against HIV1 harboring reverse transcriptase K65R mutant infected in human HeLa P4/R5 cells assessed as inhibition of viral replication, IC50=11.4μM | 19596885 | |||
| human bone marrow cells | Cytotoxicity assay | 24 hrs | Cytotoxicity against human bone marrow cells after 24 hrs by BFU-E assay, CC50=0.9μM | 20439609 | ||
| human bone marrow cells | Cytotoxicity assay | 24 hrs | Cytotoxicity against human bone marrow cells after 24 hrs by GM-CFU assay, CC50=1.9μM | 20439609 | ||
| HeLa-T4 | Antiviral assay | 48 hrs | Antiviral activity against single-round HIV1 NLX.Lux-R harboring inactivating mutations in env, vpr and carries firefly luciferase gene in place of nef infected in human HeLa-T4 cells assessed as luciferase activity after 48 hrs by exogenous RT assay, EC50=0.0029μM | 21060108 | ||
| HeLa-T4 | Antiviral assay | 48 hrs | Antiviral activity against single-round HIV1 NLX.Lux-R harboring inactivating mutations in env, vpr and carries firefly luciferase gene in place of nef infected in human HeLa-T4 cells assessed as luciferase activity after 48 hrs by exogenous RT assay, EC95=0.037μM | 21060108 | ||
| HeLaT4 | Antiviral assay | 24 hrs | Antiviral activity against single-round HIV1 NLX.Lux-R harboring inactivating mutations in env, vpr and carries firefly luciferase gene in place of nef assessed as level of infection using human HeLaT4 cells pretreated for 24 hrs followed by exposed to vi, EC50=0.12μM | 21060108 | ||
| HeLaT4 | Antiviral assay | Antiviral activity against single-round HIV1 NLX.Lux-R harboring inactivating mutations in env, vpr and carries firefly luciferase gene in place of nef assessed as level of 2 mins magnetic nanopartials-medated infection in human HeLaT4 cells treated for 1, EC99.6=0.95μM | 21060108 | |||
| HeLaT4 | Cytotoxicity assay | Cytotoxicity against human HeLaT4 cells by WST-1 assay, CC50=34μM | 21060108 | |||
| HeLaT4 | Function assay | 24 hrs | Drug uptake in human HeLaT4 cells assessed as compound persist measured after 3 times washout at 100 time EC95 for HIV1 for 24 hrs | 21060108 | ||
| HeLaT4 | Antiviral assay | 24 hrs | Antiviral activity against single-round HIV1 NLX.Lux-R harboring inactivating mutations in env, vpr and carries firefly luciferase gene in place of nef assessed as level of infection using human HeLaT4 cells pretreated at 100 time EC95 for 24 hrs followed | 21060108 | ||
| PBMC | Antiviral assay | 7 days | Antiviral activity against HIV1 infected in human PBMC assessed as inhibition of viral replication by measuring reverse transcriptase activity in cell supernatant preincubated with cells followed by viral infection measured after 7 days by radioactive inc, EC50=0.0046μM | 27405794 | ||
| HepG2.2.15 | Antiviral assay | 3 days | Antiviral activity against HBV infected in human HepG2.2.15 cells assessed as inhibition of viral DNA in cell supernatant incubated for 3 days in presence of 10% FBS followed by compound treatment in absence of 10% FBS for 3 days by qRT-PCR method, EC50=0.34μM | 27405794 | ||
| HepG2.2.15 | Cytotoxicity assay | 6 days | Cytotoxicity against human HepG2.2.15 cells assessed as reduction in cell viability after 6 days by XTT assay, CC50=29.2μM | 27405794 | ||
| PBMC | Antiviral assay | 30 mins | Antiviral activity against CXCR4-tropic HIV-1 NL4-3 infected in human PHA-stimulated PBMC assessed as inhibition of viral replication by measuring reduction in p24 antigen production preincubated with cells for 30 mins followed by viral infection measured, IC50=0.08μM | 28682067 | ||
| PBMC | Antiviral assay | 30 mins | Antiviral activity against CCR5 tropic HIV1 BaL infected in human PHA-stimulated PBMC assessed as inhibition of viral replication by measuring reduction in p24 antigen production preincubated with cells for 30 mins followed by viral infection measured on , IC50=0.22μM | 28682067 | ||
| MT4 | Antiviral assay | 6 days | Antiviral activity against CXCR4-tropic HIV-1 NL4-3 infected in human MT4 cells assessed as inhibition of virus-induced cytopathic effect after 6 days by XTT dye based assay, EC50=4.89μM | 28682067 | ||
| MT4 | Antiviral assay | 6 days | Antiviral activity against tenofovir-resistant CXCR4-tropic HIV-1 NL4-3 harboring reverse transcriptase K65R mutant infected in human MT4 cells assessed as inhibition of viral replication inhibition of virus-induced cytopathic effect after 6 days by XTT d, EC50=11.3μM | 28682067 | ||
| HepG2.2.15 | Antiviral assay | Antiviral activity against HBV infected in human HepG2.2.15 cells assessed as reduction in cytoplasmic DNA synthesis by reed and munch method, IC50=0.85μM | 31223460 | |||
| HepG2.2.15 | Cytotoxicity assay | Cytotoxicity against human HepG2.2.15 cells infected with HBV, CC50=20.71μM | 31223460 | |||
| Klicken Sie hier, um weitere experimentelle Daten zu Zelllinien anzuzeigen | ||||||
Chemische Informationen, Lagerung & Stabilität
| Molekulargewicht | 635.51 | Formel | C19H30N5O10P.C4H4O4 |
Lagerung (Ab dem Eingangsdatum) | |
|---|---|---|---|---|---|
| CAS-Nr. | 202138-50-9 | SDF herunterladen | Lagerung von Stammlösungen |
|
|
| Synonyme | GS 1278, Tenofovir DF | Smiles | CC(C)OC(=O)OCOP(=O)(COC(C)CN1C=NC2=C(N=CN=C21)N)OCOC(=O)OC(C)C.C(=CC(=O)O)C(=O)O | ||
Löslichkeit
|
In vitro |
DMSO
: 100 mg/mL
(157.35 mM)
Ethanol : 100 mg/mL Water : Insoluble |
Molaritätsrechner
|
In vivo |
|||||
In-vivo-Formulierungsrechner (Klare Lösung)
Schritt 1: Geben Sie die untenstehenden Informationen ein (Empfohlen: Ein zusätzliches Tier zur Berücksichtigung von Verlusten während des Experiments)
Schritt 2: Geben Sie die In-vivo-Formulierung ein (Dies ist nur der Rechner, keine Formulierung. Bitte kontaktieren Sie uns zuerst, wenn es im Abschnitt "Löslichkeit" keine In-vivo-Formulierung gibt.)
Berechnungsergebnisse:
Arbeitskonzentration: mg/ml;
Methode zur Herstellung der DMSO-Stammlösung: mg Wirkstoff vorgelöst in μL DMSO ( Konzentration der Stammlösung mg/mL, Bitte kontaktieren Sie uns zuerst, wenn die Konzentration die DMSO-Löslichkeit der Wirkstoffcharge überschreitet. )
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügenμL PEG300, mischen und klären, dann hinzufügenμL Tween 80, mischen und klären, dann hinzufügen μL ddH2O, mischen und klären.
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügen μL Maisöl, mischen und klären.
Hinweis: 1. Bitte stellen Sie sicher, dass die Flüssigkeit klar ist, bevor Sie das nächste Lösungsmittel hinzufügen.
2. Achten Sie darauf, das/die Lösungsmittel der Reihe nach hinzuzufügen. Sie müssen sicherstellen, dass die bei der vorherigen Zugabe erhaltene Lösung eine klare Lösung ist, bevor Sie mit der Zugabe des nächsten Lösungsmittels fortfahren. Physikalische Methoden wie Vortex, Ultraschall oder ein heißes Wasserbad können zur Unterstützung des Lösens verwendet werden.
Wirkmechanismus
| Targets/IC50/Ki |
HIV reverse transcriptase
(Cell-free assay) |
|---|---|
| In vitro |
Tenofovir wird renal durch eine Kombination aus glomerulärer Filtration und aktiver tubulärer Sekretion aus dem systemischen Kreislauf eliminiert. Tenofovir ist kein Substrat für den humanen organischen Kationentransporter Typ 1 (hOCT1) oder hOCT2. Tenofovir akkumuliert in MRP4-überexprimierenden Zellen auf fünffach niedrigere Werte, und seine Akkumulation könnte durch einen MRP-Inhibitor erhöht werden. Tenofovir verursacht keine signifikanten Veränderungen der mitochondrialen DNA (mtDNA)-Spiegel in humanen Hepato-blastom (HepG2)-Zellen, Skelettmuskelzellen (SkMCs) oder renalen proximalen Tubulusepithelzellen. Tenofovir erhöht die Laktatproduktion in HepG2-Zellen oder SkMCs um weniger als 20%. Tenofovir wird sowohl in HepG2-Zellen als auch in primären menschlichen Hepatozyten effizient zu Tenofovirdiphosphat (TFV-DP) phosphoryliert. Tenofovir hat eine 50%ige effektive Konzentration von 1,1 mM gegen HBV in zellbasierten Assays, und die Potenz wird durch die Zugabe von Bis-Isoproxil-Progruppen um > 50-fach verbessert. Tenofovir hat zuvor in vitro und klinisch volle Aktivität gegen Lamivudin-resistentes HBV gezeigt. Tenofovir hemmt die Proliferation von leberabgeleiteten HepG2-Zellen und normalen Skelettmuskelzellen mit CC(50)-Werten von 398 μM bzw. 870 μM. Tenofovir zeigt wesentlich schwächere Effekte auf die Proliferation und Viabilität von renalen proximalen Tubulusepithelzellen als Cidofovir, ein verwandtes Nukleotid-Analogon mit dem Potenzial, renale tubuläre Dysfunktion zu induzieren. |
Literatur |
|
Klinische Studieninformationen
(Daten von https://clinicaltrials.gov, aktualisiert am 2024-05-22)
| NCT-Nummer | Rekrutierung | Erkrankungen | Sponsor/Kooperationspartner | Startdatum | Phasen |
|---|---|---|---|---|---|
| NCT05874440 | Recruiting | Chronic Hepatitis b Patients |
Sohag University |
April 15 2023 | -- |
| NCT03576066 | Completed | Chronic Hepatitis B |
Assembly Biosciences |
June 11 2018 | Phase 2 |
| NCT03361956 | Completed | Hepatitis B |
Janssen Sciences Ireland UC |
February 13 2018 | Phase 2 |
| NCT02985996 | Completed | HIV Infections |
Emory University|Centers for Disease Control and Prevention |
February 6 2017 | Phase 1 |
Technischer Support
Tel: +1-832-582-8158 Ext:3
Wenn Sie weitere Fragen haben, hinterlassen Sie bitte eine Nachricht.
