nur für Forschungszwecke
Buflomedil HCl Adrenergic Receptor Antagonist
Kat.-Nr.S2607
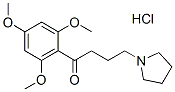
Chemische Struktur
Molekulargewicht: 343.85
Qualitätskontrolle
| Verwandte Ziele | AChR 5-HT Receptor COX Calcium Channel Histamine Receptor Dopamine Receptor GABA Receptor TRP Channel Cholinesterase (ChE) GluR |
|---|---|
| Weitere Adrenergic Receptor Inhibitoren | ICI 118551 Hydrochloride (Zenidolol) L755507 Yohimbine HCl Atipamezole Naftopidil Detomidine HCl Higenamine hydrochloride Adrenalone HCl Medetomidine HCl Deoxycorticosterone acetate |
Chemische Informationen, Lagerung & Stabilität
| Molekulargewicht | 343.85 | Formel | C17H25NO4.HCl |
Lagerung (Ab dem Eingangsdatum) | |
|---|---|---|---|---|---|
| CAS-Nr. | 35543-24-9 | SDF herunterladen | Lagerung von Stammlösungen |
|
|
| Synonyme | NSC 759291 | Smiles | COC1=CC(=C(C(=C1)OC)C(=O)CCCN2CCCC2)OC.Cl | ||
Löslichkeit
|
In vitro |
Water : 69 mg/mL
DMSO
: 31 mg/mL
(90.15 mM)
Ethanol : 7 mg/mL |
Molaritätsrechner
|
In vivo |
|||||
In-vivo-Formulierungsrechner (Klare Lösung)
Schritt 1: Geben Sie die untenstehenden Informationen ein (Empfohlen: Ein zusätzliches Tier zur Berücksichtigung von Verlusten während des Experiments)
Schritt 2: Geben Sie die In-vivo-Formulierung ein (Dies ist nur der Rechner, keine Formulierung. Bitte kontaktieren Sie uns zuerst, wenn es im Abschnitt "Löslichkeit" keine In-vivo-Formulierung gibt.)
Berechnungsergebnisse:
Arbeitskonzentration: mg/ml;
Methode zur Herstellung der DMSO-Stammlösung: mg Wirkstoff vorgelöst in μL DMSO ( Konzentration der Stammlösung mg/mL, Bitte kontaktieren Sie uns zuerst, wenn die Konzentration die DMSO-Löslichkeit der Wirkstoffcharge überschreitet. )
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügenμL PEG300, mischen und klären, dann hinzufügenμL Tween 80, mischen und klären, dann hinzufügen μL ddH2O, mischen und klären.
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügen μL Maisöl, mischen und klären.
Hinweis: 1. Bitte stellen Sie sicher, dass die Flüssigkeit klar ist, bevor Sie das nächste Lösungsmittel hinzufügen.
2. Achten Sie darauf, das/die Lösungsmittel der Reihe nach hinzuzufügen. Sie müssen sicherstellen, dass die bei der vorherigen Zugabe erhaltene Lösung eine klare Lösung ist, bevor Sie mit der Zugabe des nächsten Lösungsmittels fortfahren. Physikalische Methoden wie Vortex, Ultraschall oder ein heißes Wasserbad können zur Unterstützung des Lösens verwendet werden.
Wirkmechanismus
| In vitro |
Buflomedil erhöht die intrazellulären cAMP-Spiegel in menschlichen Keratinozyten, entweder sekundär zur Phosphodiesterase-Hemmung (PTX) oder zur Adenylatcyclase-Stimulation (BC). Buflomedil verringert die TPA-induzierte TNF-alpha- und IL-8-Freisetzung aus Keratinozyten; im Fall von IL-8 ist es möglich, dass diese Hemmung auf transkriptioneller Ebene erfolgt. Buflomedil hemmt die Epinephrin-induzierte Aggregation auf mikromolarer Ebene signifikant. Buflomedil führt zu einer schwachen Hemmung der ADP- und Kollagen-induzierten Aggregation. Buflomedil hemmt die granuläre Sekretion und die Interaktion von Fibrinogen mit seinem Rezeptor auf den Thrombozyten. Buflomedil-Hydrochlorid verbessert die kapilläre Perfusion in solchen verwandten Situationen und ruft einen möglichen Effekt auf Neutrophile hervor. Buflomedil verringert 100 % der Histamin-bezogenen Neutrophilenadhäsion (Flusssystem) und hemmt teilweise die Adhäsion nach IL-1-4 Stunden (Fluss- und stabile Systeme). Buflomedil verringert die Expression von P-Selektin an der Oberfläche von Endothelzellen und die Hypoxie-induzierte Neutrophilenadhäsion. |
|---|---|
| In vivo |
Buflomedil (6 mg/kg) erhöht das Überleben von Lappen bei Nikotin-behandelten Ratten. Buflomedil (3 mg/kg) reduziert signifikant sowohl das postischämische kapilläre Perfusionsversagen als auch die Leukozytenadhäsion in Venulen. Buflomedil reduziert die durch Phentolamin hervorgerufene Vasodilatation und potenziert dessen depressiven Effekt auf die Vasomotionsfrequenz und -amplitude im Hamster-Backentaschenmodell. |
Literatur |
|
Technischer Support
Tel: +1-832-582-8158 Ext:3
Wenn Sie weitere Fragen haben, hinterlassen Sie bitte eine Nachricht.
