nur für Forschungszwecke
JTE 013 S1P Receptor Antagonist
Kat.-Nr.S7182
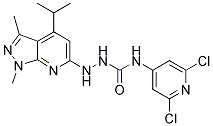
Chemische Struktur
Molekulargewicht: 408.29
Qualitätskontrolle
- In Nature Medicine für seine erstklassige Qualität zitiert
- COA
- NMR
- SDS
- Datenblatt
| Verwandte Ziele | CXCR Hedgehog/Smoothened PKA Adrenergic Receptor AChR 5-HT Receptor Histamine Receptor Dopamine Receptor Ras KRas |
|---|---|
| Weitere S1P Receptor Inhibitoren | PF 429242 CAY10444 CYM5541 CYM-5520 SEW 2871 SLF1081851 hydrochloride CYM50308 MP-A08 Etrasimod(APD334) K145 |
Chemische Informationen, Lagerung & Stabilität
| Molekulargewicht | 408.29 | Formel | C17H19Cl2N7O |
Lagerung (Ab dem Eingangsdatum) | |
|---|---|---|---|---|---|
| CAS-Nr. | 383150-41-2 | SDF herunterladen | Lagerung von Stammlösungen |
|
|
| Synonyme | N/A | Smiles | CC1=NN(C2=C1C(=CC(=N2)NNC(=O)NC3=CC(=NC(=C3)Cl)Cl)C(C)C)C | ||
Löslichkeit
|
In vitro |
DMSO
: 81 mg/mL
(198.38 mM)
Ethanol : 34 mg/mL Water : Insoluble |
Molaritätsrechner
|
In vivo |
|||||
In-vivo-Formulierungsrechner (Klare Lösung)
Schritt 1: Geben Sie die untenstehenden Informationen ein (Empfohlen: Ein zusätzliches Tier zur Berücksichtigung von Verlusten während des Experiments)
Schritt 2: Geben Sie die In-vivo-Formulierung ein (Dies ist nur der Rechner, keine Formulierung. Bitte kontaktieren Sie uns zuerst, wenn es im Abschnitt "Löslichkeit" keine In-vivo-Formulierung gibt.)
Berechnungsergebnisse:
Arbeitskonzentration: mg/ml;
Methode zur Herstellung der DMSO-Stammlösung: mg Wirkstoff vorgelöst in μL DMSO ( Konzentration der Stammlösung mg/mL, Bitte kontaktieren Sie uns zuerst, wenn die Konzentration die DMSO-Löslichkeit der Wirkstoffcharge überschreitet. )
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügenμL PEG300, mischen und klären, dann hinzufügenμL Tween 80, mischen und klären, dann hinzufügen μL ddH2O, mischen und klären.
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügen μL Maisöl, mischen und klären.
Hinweis: 1. Bitte stellen Sie sicher, dass die Flüssigkeit klar ist, bevor Sie das nächste Lösungsmittel hinzufügen.
2. Achten Sie darauf, das/die Lösungsmittel der Reihe nach hinzuzufügen. Sie müssen sicherstellen, dass die bei der vorherigen Zugabe erhaltene Lösung eine klare Lösung ist, bevor Sie mit der Zugabe des nächsten Lösungsmittels fortfahren. Physikalische Methoden wie Vortex, Ultraschall oder ein heißes Wasserbad können zur Unterstützung des Lösens verwendet werden.
Wirkmechanismus
| Targets/IC50/Ki |
S1PR2(human)
(in CHO cells) 17 nM
S1PR2(rat)
(in CHO cells) 22 nM
|
|---|---|
| In vitro |
JTE-013 kehrt die hemmenden Effekte der S1P2-Signalgebung auf die Zellmigration von vaskulären ECs und glatten Muskelzellen um. Es reguliert endotheliale Tight Junctions und die Barrierefunktion in vitro. Die Blockade der S1P2-Signalgebung durch JTE-013 verstärkt signifikant die Effekte von S1P auf die Erhöhung des TEER, eine In-vitro-Messung der endothelialen Integrität, sowie die Bildung von TJs in seneszenten ECs.
|
| In vivo |
JTE-013-Hemmung von S1P2 hemmt signifikant die mikrovaskuläre Permeabilität in einem In-vivo-Tiermodell. JTE-013 moduliert die Reaktionen des Gehirnendothels durch Hemmung der zerebrovaskulären Permeabilität, der Entwicklung intrazerebraler Blutungen und neurovaskulärer Verletzungen in einem experimentellen Schlaganfallmodell. JTE-013 reduzierte die Mastzellaktivierung, die Atemwegsinfiltration und die Serumspiegel von Histamin und verschiedenen Zytokinen in In-vitro- und In-vivo-Studien. In einem murinen Modell unterdrückt JTE-013 Streptozotocin-induzierte Blutzuckererhöhungen, die Apoptose der Pankreas-b-Zellen und die Inzidenz von Diabetes. In einem neuseeländischen Modell für adipöse Diabetiker unter High-Fat-Diät-Bedingungen schützte es die Pankreas-b-Zellen. Die Behandlung mit JTE-013 reduziert auch die Plasmaspiegel von IL-1b und IL-18 (Endotoxin-induzierte entzündliche Zytokine) in ApoE−/−-Mäusen, und S1P2-Gendefizienz reduziert Atherosklerose. Die Verbindung bietet ein neuartiges Mittel zur Behandlung entzündlicher Erkrankungen wie Atherosklerose und Sepsis.
|
Literatur |
|
Anwendungen
| Methoden | Biomarker | Bilder | PMID |
|---|---|---|---|
| Western blot | SK1 / SK2 |
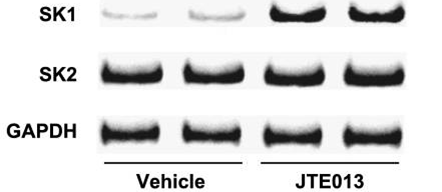
|
22095950 |
Technischer Support
Tel: +1-832-582-8158 Ext:3
Wenn Sie weitere Fragen haben, hinterlassen Sie bitte eine Nachricht.
