nur für Forschungszwecke
PNU-120596 AChR Modulator
Kat.-Nr.S2629
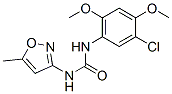
Chemische Struktur
Molekulargewicht: 311.72
Qualitätskontrolle
Chemische Informationen, Lagerung & Stabilität
| Molekulargewicht | 311.72 | Formel | C13H14ClN3O4 |
Lagerung (Ab dem Eingangsdatum) | |
|---|---|---|---|---|---|
| CAS-Nr. | 501925-31-1 | SDF herunterladen | Lagerung von Stammlösungen |
|
|
| Synonyme | Nsc 216666 | Smiles | CC1=CC(=NO1)NC(=O)NC2=CC(=C(C=C2OC)OC)Cl | ||
Löslichkeit
|
In vitro |
DMSO
: 62 mg/mL
(198.89 mM)
Ethanol : 1 mg/mL Water : Insoluble |
Molaritätsrechner
|
In vivo |
|||||
In-vivo-Formulierungsrechner (Klare Lösung)
Schritt 1: Geben Sie die untenstehenden Informationen ein (Empfohlen: Ein zusätzliches Tier zur Berücksichtigung von Verlusten während des Experiments)
Schritt 2: Geben Sie die In-vivo-Formulierung ein (Dies ist nur der Rechner, keine Formulierung. Bitte kontaktieren Sie uns zuerst, wenn es im Abschnitt "Löslichkeit" keine In-vivo-Formulierung gibt.)
Berechnungsergebnisse:
Arbeitskonzentration: mg/ml;
Methode zur Herstellung der DMSO-Stammlösung: mg Wirkstoff vorgelöst in μL DMSO ( Konzentration der Stammlösung mg/mL, Bitte kontaktieren Sie uns zuerst, wenn die Konzentration die DMSO-Löslichkeit der Wirkstoffcharge überschreitet. )
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügenμL PEG300, mischen und klären, dann hinzufügenμL Tween 80, mischen und klären, dann hinzufügen μL ddH2O, mischen und klären.
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügen μL Maisöl, mischen und klären.
Hinweis: 1. Bitte stellen Sie sicher, dass die Flüssigkeit klar ist, bevor Sie das nächste Lösungsmittel hinzufügen.
2. Achten Sie darauf, das/die Lösungsmittel der Reihe nach hinzuzufügen. Sie müssen sicherstellen, dass die bei der vorherigen Zugabe erhaltene Lösung eine klare Lösung ist, bevor Sie mit der Zugabe des nächsten Lösungsmittels fortfahren. Physikalische Methoden wie Vortex, Ultraschall oder ein heißes Wasserbad können zur Unterstützung des Lösens verwendet werden.
Wirkmechanismus
| Targets/IC50/Ki |
α7 nAChR
216 nM(EC50)
|
|---|---|
| In vitro |
PNU-120596 erhöht den durch Agonist (Ach) ausgelösten Kalziumfluss, der durch eine gentechnisch veränderte Variante des humanen α7 nAChR vermittelt wird. Diese Verbindung erhöht die durch Agonisten (Cholin und ACh) ausgelösten Ströme, die durch Wildtyp-Rezeptoren vermittelt werden, und zeigt auch eine ausgeprägte Verlängerung der ausgelösten Reaktion in fortgesetzter Anwesenheit des Agonisten in Xenopus-Oozyten. Sie erhöht die mittlere Offenzeit der α7 nAChRs, hat aber keine Auswirkung auf die Ionen-Selektivität und relativ geringe, wenn überhaupt, Auswirkungen auf die Einzelleitfähigkeit. Bei Anwendung auf akute Hippocampus-Schnitten erhöht diese Chemikalie die Frequenz der ACh-ausgelösten GABAergen postsynaptischen Ströme, die in Pyramidenneuronen gemessen werden; dieser Effekt wird durch TTX unterdrückt, was darauf hindeutet, dass sie die Funktion von α7 nAChRs moduliert, die sich auf der somatodendritischen Membran von Hippocampus-Interneuronen befinden. Neben der positiven Modulation von α7 nAChR induziert diese Verbindung eine tiefgreifende Verzögerung der Kinetik der Desensibilisierung, was das Potenzial einer Ca2+-induzierten Toxizität durch übermäßige Stimulation von α7 nAChR erhöht. Sie verursacht Veränderungen der Cysteinzugänglichkeit am inneren Beta-Faltblatt, der Übergangszone und der Agonistenbindungsstelle, während sie an α7 nAChR bindet. Die Bindungsstellen für diese Chemikalie befinden sich nicht an den Agonistenbindungsstellen, und sie verstärkt die Agonisten-ausgelöste Gating von nikotinischen Rezeptoren, indem sie konformative Effekte hervorruft, die ähnlich, aber nicht identisch mit den durch Ach geförderten Gating-Konformationen sind.
|
| Kinase-Assay |
Ca2+-Fluoreszenz-Assay
|
|
SH-EP1 menschliche Epithelzellen, die eine Variante des α7 nAChR (α7*) exprimieren, werden in minimalem essentiellem Medium (MEM) kultiviert, das nicht-essentielle Aminosäuren enthält und mit 10% fötalem Rinderserum, L-Glutamin, 100 U/ml Penicillin/Streptomycin, 250 ng/mL Fungizone, 400 μg/mL Hygromycin B und 800 μg/mL Geneticin ergänzt ist. α7* ist eine Variante des humanen α7 nAChR mit zwei Punktmutationen in der ersten Transmembrandomäne (T230P und C241S), die eine hohe funktionelle Expression in SH-EP1-Zellen ermöglichen [Groppi VE, Wolfe ML, Berkenpas MB (2003) U.S. Patent 6,693,172 B1]. Die Zellen werden in einem 37 °C Inkubator mit 6% CO2 kultiviert. Die Zellen werden trypsinisiert und in 96-Well-Platten mit dunklen Seitenwänden und klaren Böden in einer Dichte von 2 × 104 Zellen/Well 2 Tage vor der Analyse plattiert. Die Zellen werden mit einer Mischung aus Calcium Green-1 AM in wasserfreiem Dimethylsulfoxid und 20% Pluronic F-127 beladen. Dieses Reagenz wird direkt zum Wachstumsmedium jeder Vertiefung hinzugefügt, um eine Endkonzentration von 2 μM Calcium Green-1 AM zu erreichen. Die Zellen werden dann 1 Stunde lang bei 37 °C in dem Farbstoff inkubiert und anschließend viermal mit Mark's modifizierter Earle's Balanced Salt Solution (MMEBSS) gewaschen, die aus folgenden Bestandteilen besteht (in mM): 4 CaCl2, 0.8 MgSO4, 20 NaCl, 5.3 KCl, 5.6 D-Glucose, 20 Tris-HEPES und 120 N-Methyl-D-Glucamin, pH 7.4. Nach dem vierten Zyklus werden die Zellen mindestens 10 Minuten lang bei 37 °C inkubiert. Das endgültige Volumen von MMEBSS in jeder Vertiefung beträgt 100 μL und Atropin wird allen Vertiefungen für eine Endkonzentration von 1 μM hinzugefügt. Ein fluorometrischer Imaging Plate Reader (FLIPR; Molecular Devices, Union City, CA) wird so eingestellt, dass er Calcium Green bei 488 nm mit 500 mW Leistung anregt und die Fluoreszenzemission von >525 nm misst. Eine Belichtungszeit von 0.5 Sekunden wird verwendet, um jede Vertiefung zu beleuchten. Die Fluoreszenz wird mit einem F-Stop-Wert von entweder 2.0 oder 1.2 detektiert. Nach 30 Sekunden Basismessung werden Testverbindungen in 50 μL einer 3 × Stammlösung zu jeder Vertiefung einer 96-Well-Platte hinzugefügt. In jedem Experiment werden vier Vertiefungen als Vehikel (0.2% DMSO)-Kontrollen verwendet.
|
|
| In vivo |
Die systemische Verabreichung von PNU-120596 (1 mg/kg) an Ratten verbessert das durch Amphetamin verursachte auditive Gating-Defizit, ein Modell, das eine Störung auf Schaltkreisebene im Zusammenhang mit Schizophrenie widerspiegeln soll. Bei Verabreichung vor Carrageenan schwächt 30 mg/kg dieser Verbindung die mechanische Hyperalgesie und die Beeinträchtigung der Gewichtsbelastung für bis zu 4 Stunden signifikant ab. Diese Chemikalie dämpft den durch Carrageenan induzierten Anstieg der TNF-α- und IL-6-Spiegel im Ödem der Hinterpfote, während Diclofenac nur die IL-6-Spiegel dämpfte. Eine etablierte mechanische Hyperalgesie, die durch Carrageenan oder CFA induziert wird, wird ebenfalls teilweise durch dieses Mittel umgekehrt.
|
Literatur |
|
Technischer Support
Tel: +1-832-582-8158 Ext:3
Wenn Sie weitere Fragen haben, hinterlassen Sie bitte eine Nachricht.
