nur für Forschungszwecke
Tosedostat (CHR2797) Aminopeptidase Inhibitor
Kat.-Nr.S1522
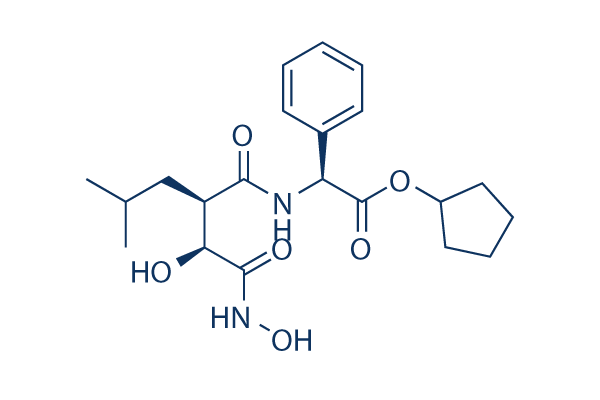
Chemische Struktur
Molekulargewicht: 406.47
Qualitätskontrolle
| Verwandte Ziele | Dehydrogenase HSP Transferase P450 (e.g. CYP17) PDE phosphatase PPAR Vitamin Carbohydrate Metabolism Mitochondrial Metabolism |
|---|---|
| Weitere Aminopeptidase Inhibitoren | Bestatin hydrochloride |
Chemische Informationen, Lagerung & Stabilität
| Molekulargewicht | 406.47 | Formel | C21H30N2O6 |
Lagerung (Ab dem Eingangsdatum) | |
|---|---|---|---|---|---|
| CAS-Nr. | 238750-77-1 | SDF herunterladen | Lagerung von Stammlösungen |
|
|
Löslichkeit
|
In vitro |
DMSO
: 56 mg/mL
(137.77 mM)
Ethanol : 14 mg/mL Water : Insoluble |
Molaritätsrechner
|
In vivo |
|||||
In-vivo-Formulierungsrechner (Klare Lösung)
Schritt 1: Geben Sie die untenstehenden Informationen ein (Empfohlen: Ein zusätzliches Tier zur Berücksichtigung von Verlusten während des Experiments)
Schritt 2: Geben Sie die In-vivo-Formulierung ein (Dies ist nur der Rechner, keine Formulierung. Bitte kontaktieren Sie uns zuerst, wenn es im Abschnitt "Löslichkeit" keine In-vivo-Formulierung gibt.)
Berechnungsergebnisse:
Arbeitskonzentration: mg/ml;
Methode zur Herstellung der DMSO-Stammlösung: mg Wirkstoff vorgelöst in μL DMSO ( Konzentration der Stammlösung mg/mL, Bitte kontaktieren Sie uns zuerst, wenn die Konzentration die DMSO-Löslichkeit der Wirkstoffcharge überschreitet. )
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügenμL PEG300, mischen und klären, dann hinzufügenμL Tween 80, mischen und klären, dann hinzufügen μL ddH2O, mischen und klären.
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügen μL Maisöl, mischen und klären.
Hinweis: 1. Bitte stellen Sie sicher, dass die Flüssigkeit klar ist, bevor Sie das nächste Lösungsmittel hinzufügen.
2. Achten Sie darauf, das/die Lösungsmittel der Reihe nach hinzuzufügen. Sie müssen sicherstellen, dass die bei der vorherigen Zugabe erhaltene Lösung eine klare Lösung ist, bevor Sie mit der Zugabe des nächsten Lösungsmittels fortfahren. Physikalische Methoden wie Vortex, Ultraschall oder ein heißes Wasserbad können zur Unterstützung des Lösens verwendet werden.
Wirkmechanismus
| Targets/IC50/Ki |
LAP
100 nM
PuSA
150 nM
Aminopeptidase N
220 nM
|
|---|---|
| In vitro |
CHR-2797 hat nahezu keine Wirkung auf die Aktivität von Aminopeptidase B, PILSAP, LTA4 Hydrolase und MetAP-2 mit IC50-Werten von >1 uM, >5 uM, >10 uM bzw. >30 uM. CHR-2797 wird in Zellen in ein pharmakologisch aktives Säureprodukt (CHR-79888) umgewandelt, das eine signifikante hemmende Aktivität gegenüber LTA4 Hydrolase mit einer IC50 von 8 nM zeigt. CHR-2797 zeigt ausgeprägte antiproliferative Effekte gegen eine Reihe von Krebszelllinien wie U-937, HL-60, KG-1 und GDM-1 mit IC50-Werten von 10 nM, 30 nM, 15 nM bzw. 15 nM, ist jedoch inaktiv gegen HuT 78 und Jurkat E6-1 mit IC50-Werten von >10 uM. Es gibt keine offensichtliche Korrelation zwischen der Empfindlichkeit gegenüber CHR-2797 und dem Mutationsstatus von p53, PTEN oder K-Ras in Zellen. CHR-2797 zeigt eine Selektivität für transformierte Zellen (MrC5-SV2 oder K-ras NRK) gegenüber nicht-transformierten Zellen (MrC5 oder NRK). Die Behandlung mit CHR-2797 (6 μM) führt zur Hochregulierung von Genen, die am Aminosäuretransport und an Stoffwechselwegen beteiligt sind, zur Phosphorylierung des eukaryotischen Initiationsfaktors 2α, zur Hemmung der Phosphorylierung von mTOR-Substraten und zu einer reduzierten Proteinsynthese in HL-60-Zellen.
|
| Kinase-Assay |
Aminopeptidase-Assays
|
|
Die LAP-Aktivität wird durch Messung der Hydrolyse des Tripeptids LGG bestimmt, die durch das Derivatisierungsreagenz OPA in Gegenwart von β-Mercaptoethanol nachgewiesen wird. Der Assay wird in 96-Well-Assayplatten durchgeführt. Die Wells enthalten verdünntes CHR-2797 (5 μL), 10 μg/mL LAP (5 μL) und 40 μL 0,5 mM LGG. Die Platte wird kurz geschüttelt und 90 Minuten bei 37 °C inkubiert. Die Reaktion wird durch Zugabe von 200 μL OPA/β-Mercaptoethanol pro Well beendet. Die Platte wird mit dem Victor Wallac3-Plattenlesegerät bei einer Anregung von 355 nm und einer Emission von 460 nm abgelesen. Die PuSA-Aktivität wird unter Verwendung des fluorogenen Substrats Ala-AMC bestimmt. Die Inkubationsmischung enthält verdünntes CHR-2797 (20 μL), Substrat (125 μM Ala-AMC in 0,125 M Tris-HCl-Puffer, pH 7,5; 40 μL) und Enzym (40 μL). Nach einer Inkubation von 2 Stunden bei 37 °C wird die Reaktion durch Zugabe von 100 μL 3 % (v/v) Essigsäure gestoppt. Die Fluoreszenz wird mit einem SLT Fluostar Fluorimeter gemessen. Aminopeptidase N wird unter Verwendung des fluorogenen Substrats Ala-AMC getestet. Die Inkubationsmischung enthält verdünntes CHR-2797 (20 μL), Substrat (40 μL; Endkonzentration, 60 μM) und Enzym (40 μL, 1:8000 Verdünnung) und wird 60 Minuten bei 37 °C inkubiert, bevor 100 μL 3 % (v/v) Essigsäure zur Beendigung der Reaktion hinzugefügt werden. Die Fluoreszenz wird mit einem SLT Fluostar Fluorimeter gemessen.
|
|
| In vivo |
Die Verabreichung von CHR-2797 (~100 mg/kg) verringert in vivo das Tumorvolumen im Vergleich zu Kontrollen dosisabhängig im Ratten-HOSP.1-Lungenkolonisierungsmodell, im Ratten-HSN LV10-Chondrosarkom-Leberkolonisierungsmodell, im menschlichen MDA-MB-435-Brustkrebs-Spontanmetastasenmodell und im menschlichen MDA-MB-468-Zell-Xenograftmodell.
|
Literatur |
Klinische Studieninformationen
(Daten von https://clinicaltrials.gov, aktualisiert am 2024-05-22)
| NCT-Nummer | Rekrutierung | Erkrankungen | Sponsor/Kooperationspartner | Startdatum | Phasen |
|---|---|---|---|---|---|
| NCT01180426 | Unknown status | Acute Myeloid Leukemia |
Chroma Therapeutics |
June 2010 | Phase 2 |
| NCT00780598 | Completed | Acute Myeloid Leukemia|AML |
Chroma Therapeutics|Quintiles Inc. |
October 2009 | Phase 2 |
| NCT00522938 | Terminated | Carcinoma Non-Small-Cell Lung |
Chroma Therapeutics |
December 2007 | Phase 1|Phase 2 |
| NCT00737555 | Completed | Solid Tumor |
Chroma Therapeutics |
August 2006 | Phase 1 |
| NCT00689000 | Completed | Acute Myeloid Leukemia|Myelodysplastic Syndrome|Multiple Myeloma |
Chroma Therapeutics |
May 2006 | Phase 1|Phase 2 |
Technischer Support
Tel: +1-832-582-8158 Ext:3
Wenn Sie weitere Fragen haben, hinterlassen Sie bitte eine Nachricht.
