nur für Forschungszwecke
Candesartan Cilexetil Angiotensin Receptor Antagonist
Kat.-Nr.S2037
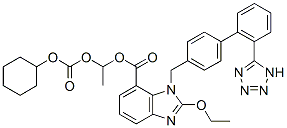
Chemische Struktur
Molekulargewicht: 610.66
Qualitätskontrolle
| Verwandte Ziele | CXCR Hedgehog/Smoothened PKA Adrenergic Receptor AChR 5-HT Receptor Histamine Receptor Dopamine Receptor Ras KRas |
|---|---|
| Weitere Angiotensin Receptor Inhibitoren | PD123319 ML221 A-779 Fimasartan Olodanrigan (EMA401) Buloxibutid AVE 0991 |
Chemische Informationen, Lagerung & Stabilität
| Molekulargewicht | 610.66 | Formel | C33H34N6O6 |
Lagerung (Ab dem Eingangsdatum) | |
|---|---|---|---|---|---|
| CAS-Nr. | 145040-37-5 | SDF herunterladen | Lagerung von Stammlösungen |
|
|
| Synonyme | TCV-116 | Smiles | CCOC1=NC2=CC=CC(=C2N1CC3=CC=C(C=C3)C4=CC=CC=C4C5=NNN=N5)C(=O)OC(C)OC(=O)OC6CCCCC6 | ||
Löslichkeit
|
In vitro |
DMSO
: 122 mg/mL
(199.78 mM)
Ethanol : 4 mg/mL Water : Insoluble |
Molaritätsrechner
|
In vivo |
|||||
In-vivo-Formulierungsrechner (Klare Lösung)
Schritt 1: Geben Sie die untenstehenden Informationen ein (Empfohlen: Ein zusätzliches Tier zur Berücksichtigung von Verlusten während des Experiments)
Schritt 2: Geben Sie die In-vivo-Formulierung ein (Dies ist nur der Rechner, keine Formulierung. Bitte kontaktieren Sie uns zuerst, wenn es im Abschnitt "Löslichkeit" keine In-vivo-Formulierung gibt.)
Berechnungsergebnisse:
Arbeitskonzentration: mg/ml;
Methode zur Herstellung der DMSO-Stammlösung: mg Wirkstoff vorgelöst in μL DMSO ( Konzentration der Stammlösung mg/mL, Bitte kontaktieren Sie uns zuerst, wenn die Konzentration die DMSO-Löslichkeit der Wirkstoffcharge überschreitet. )
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügenμL PEG300, mischen und klären, dann hinzufügenμL Tween 80, mischen und klären, dann hinzufügen μL ddH2O, mischen und klären.
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügen μL Maisöl, mischen und klären.
Hinweis: 1. Bitte stellen Sie sicher, dass die Flüssigkeit klar ist, bevor Sie das nächste Lösungsmittel hinzufügen.
2. Achten Sie darauf, das/die Lösungsmittel der Reihe nach hinzuzufügen. Sie müssen sicherstellen, dass die bei der vorherigen Zugabe erhaltene Lösung eine klare Lösung ist, bevor Sie mit der Zugabe des nächsten Lösungsmittels fortfahren. Physikalische Methoden wie Vortex, Ultraschall oder ein heißes Wasserbad können zur Unterstützung des Lösens verwendet werden.
Wirkmechanismus
| Targets/IC50/Ki |
Ang II receptor
0.26 nM
|
|---|---|
| In vitro |
Candesartan blockiert die Wirkungen von Angiotensin II am Angiotensin-II-Typ-1 (AT1)-Rezeptor. Candesartan Cilexetil ist ein Prodrug, das während der gastrointestinalen Absorption durch Esterhydrolyse zu Candesartan aktiviert wird.
|
| In vivo |
Candesartan verbessert die funktionellen Marker dosisabhängig und reguliert auch Ang (1-7), ACE2 und mas1 im Myokard von DCM-Ratten hoch. Candesartan reduziert verschiedene ER-Stress- und Apoptosemarker sowie die Anzahl apoptotischer Zellen bei mit Candesartan behandelten Ratten. Candesartan Cilexetil zeigt eine Angiotensin-II-blockierende Wirkung in dosisabhängiger Weise bei Ratten mit dilatativer Kardiomyopathie. Candesartan Cilexetil reduziert den linksventrikulären enddiastolischen Druck und das Herzgewicht/Körpergewicht-Verhältnis, die Fläche der Myokardfibrose und die Expressionen von transformierendem Wachstumsfaktor-beta1 und Kollagen-III-mRNA. Candesartan Cilexetil (1 mg/kg, p.o.) und Enalapril (10 mg/kg, p.o.) senken den Blutdruck 5 Stunden nach der Verabreichung am 1. und 7. Tag im gleichen Maße. Candesartan Cilexetil erhöht signifikant den renalen Blutfluss ohne Änderungen des Herzindex. TCV-116 und Enalapril tendieren auch dazu, den splanchnischen Blutfluss nach der 1. Dosis zu erhöhen, jedoch nicht nach der 7. Dosis. Candesartan Cilexetil wird aus dem Dünndarm resorbiert und während des Absorptionsprozesses vollständig zu dem pharmakologisch aktiven Metaboliten M-I hydrolysiert.
|
Literatur |
|
Klinische Studieninformationen
(Daten von https://clinicaltrials.gov, aktualisiert am 2024-05-22)
| NCT-Nummer | Rekrutierung | Erkrankungen | Sponsor/Kooperationspartner | Startdatum | Phasen |
|---|---|---|---|---|---|
| NCT02609711 | Unknown status | Healthy Male Subjects |
Ahn-Gook Pharmaceuticals Co.Ltd |
November 2015 | Phase 1 |
| NCT00984529 | Completed | Chronic Heart Failure |
AstraZeneca |
September 2009 | -- |
| NCT00844324 | Completed | Hypertension |
AstraZeneca |
March 2009 | Phase 1 |
| NCT00244595 | Completed | Hypertension |
AstraZeneca |
September 2003 | Phase 3 |
| NCT00244634 | Completed | Pediatric Hypertension |
AstraZeneca |
September 2003 | Phase 3 |
| NCT00242346 | Completed | Proteinuria |
AstraZeneca |
April 2003 | Phase 3 |
Technischer Support
Tel: +1-832-582-8158 Ext:3
Wenn Sie weitere Fragen haben, hinterlassen Sie bitte eine Nachricht.
