nur für Forschungszwecke
Apitolisib (GDC-0980) PI3K Inhibitor
Kat.-Nr.S2696
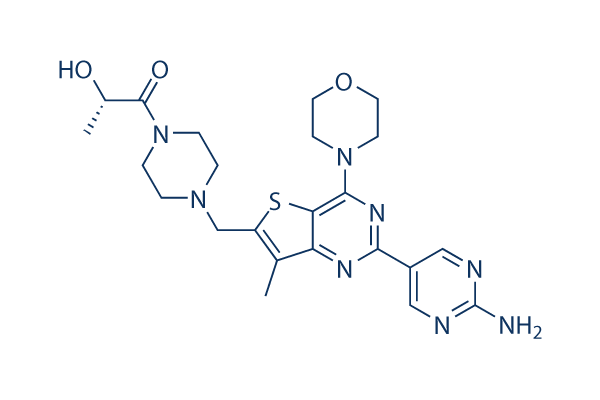
Chemische Struktur
Molekulargewicht: 498.6
Qualitätskontrolle
| Verwandte Ziele | Akt mTOR GSK-3 ATM/ATR DNA-PK AMPK PDPK1 PTEN PP2A PDK |
|---|---|
| Weitere PI3K Inhibitoren | GDC-0077 (Inavolisib) SAR405 Quercetin (Sophoretin) LY294002 XL147 analogue Tersolisib (STX-478) Buparlisib (BKM120) 740 Y-P (PDGFR 740Y-P) GO-203 TFA Eganelisib (IPI-549) |
Zellkultur, Behandlung & Arbeitskonzentration
| Zelllinien | Assay-Typ | Konzentration | Inkubationszeit | Formulierung | Aktivitätsbeschreibung | PMID |
|---|---|---|---|---|---|---|
| insect cells | Function assay | 30 mins | Inhibition of human recombinant mTOR expressed in insect cells assessed as phosphorylation of recombinant (GFP)-4-EBP1 measured after 30 mins by fluorescence polarization assay, Ki=0.017μM | 21981714 | ||
| PC3 | Function assay | Inhibition of PIK3 gamma-mediated Akt phosphorylation at Ser473 in human PC3 cells by ELISA, IC50=0.036μM | 21981714 | |||
| MCF7.1 | Antiproliferative assay | Antiproliferative activity against human MCF7.1 cells expressing HER2 gene after overnight incubation by CellTiter-Glo luminescence assay, IC50=0.255μM | 21981714 | |||
| PC3 | Antiproliferative assay | Antiproliferative activity against human PC3 cells after overnight incubation by CellTiter-Glo luminescence assay, IC50=0.307μM | 21981714 | |||
| PC3 | Antitumor assay | 1 mg/kg | 14 days | Antitumor activity against human PC3 cells xenografted in athymic nu/nu mouse assessed as delay in tumor growth at 1 mg/kg, po qd for 14 days | 21981714 | |
| MCF7-neo | Antitumor assay | 1 mg/kg | 22 days | Antitumor activity against human MCF7-neo cells expressing HER2 gene xenografted in athymic nu/nu mouse assessed as delay in tumor growth at 1 mg/kg, po qd for 22 days | 21981714 | |
| PC3 | Antitumor assay | Antitumor activity against human PC3 cells xenografted in athymic nu/nu mouse assessed as tumor regression at maximum tolerated dose | 21981714 | |||
| MCF7-neo | Antitumor assay | Antitumor activity against human MCF7-neo cells expressing HER2 gene xenografted in athymic nu/nu mouse assessed as tumor regression at maximum tolerated dose | 21981714 | |||
| PC3 | Antitumor assay | 14 days | Antitumor activity against human PC3 cells xenografted in athymic nu/nu mouse assessed as tumor stasis at maximum tolerated dose measured on day 14 | 21981714 | ||
| MCF7-neo | Antitumor assay | 22 days | Antitumor activity against human MCF7-neo cells expressing HER2 gene xenografted in athymic nu/nu mouse assessed as tumor stasis at maximum tolerated dose measured on day 22 | 21981714 | ||
| PC3 | Function assay | 10 mg/kg | 6 hrs | Inhibition of mTORC2 in human PC3 cells xenografted mouse assessed as reduction of phosphorylated Akt level at 10 mg/kg, po after 6 hrs | 23199076 | |
| PC3 | Function assay | 10 mg/kg | 6 hrs | Inhibition of mTORC1 in human PC3 cells xenografted mouse assessed as reduction of phosphorylated p70S6K level at 10 mg/kg, po after 6 hrs | 23199076 | |
| insect cells | Function assay | 30 mins | Inhibition of human recombinant mTOR (1360 to 2549 residues) expressed in insect cells assessed as inhibition of GFP-labeled 4-EBP1 phosphorylation at Thr-37/46 residues incubated for 30 mins by FRET assay, Ki=0.017μM | 27096040 | ||
| PC3 | Antiproliferative assay | 3 days | Antiproliferative activity against human PC3 cells after 3 days by CellTitre-Glo assay, EC50=0.31μM | 27096040 | ||
| VERO-E6 | Toxicity assay | 48 hrs | Toxicity CC50 against VERO-E6 cells determined at 48 hours by high content imaging (same conditions as 2_LEY without exposure to 0.01 MOI SARS CoV-2 virus), CC50=0.5μM | ChEMBL | ||
| VERO-E6 | Function assay | 48 hrs | Determination of IC50 values for inhibition of SARS-CoV-2 induced cytotoxicity of VERO-E6 cells after 48 hours exposure to 0.01 MOI SARS CoV-2 virus by high content imaging, IC50=2.31μM | ChEMBL | ||
| Klicken Sie hier, um weitere experimentelle Daten zu Zelllinien anzuzeigen | ||||||
Chemische Informationen, Lagerung & Stabilität
| Molekulargewicht | 498.6 | Formel | C23H30N8O3S |
Lagerung (Ab dem Eingangsdatum) | |
|---|---|---|---|---|---|
| CAS-Nr. | 1032754-93-0 | SDF herunterladen | Lagerung von Stammlösungen |
|
|
| Synonyme | RG7422, GNE 390 | Smiles | CC1=C(SC2=C1N=C(N=C2N3CCOCC3)C4=CN=C(N=C4)N)CN5CCN(CC5)C(=O)C(C)O | ||
Löslichkeit
|
In vitro |
DMSO
: 27 mg/mL
(54.15 mM)
Water : Insoluble Ethanol : Insoluble |
Molaritätsrechner
|
In vivo |
|||||
In-vivo-Formulierungsrechner (Klare Lösung)
Schritt 1: Geben Sie die untenstehenden Informationen ein (Empfohlen: Ein zusätzliches Tier zur Berücksichtigung von Verlusten während des Experiments)
Schritt 2: Geben Sie die In-vivo-Formulierung ein (Dies ist nur der Rechner, keine Formulierung. Bitte kontaktieren Sie uns zuerst, wenn es im Abschnitt "Löslichkeit" keine In-vivo-Formulierung gibt.)
Berechnungsergebnisse:
Arbeitskonzentration: mg/ml;
Methode zur Herstellung der DMSO-Stammlösung: mg Wirkstoff vorgelöst in μL DMSO ( Konzentration der Stammlösung mg/mL, Bitte kontaktieren Sie uns zuerst, wenn die Konzentration die DMSO-Löslichkeit der Wirkstoffcharge überschreitet. )
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügenμL PEG300, mischen und klären, dann hinzufügenμL Tween 80, mischen und klären, dann hinzufügen μL ddH2O, mischen und klären.
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügen μL Maisöl, mischen und klären.
Hinweis: 1. Bitte stellen Sie sicher, dass die Flüssigkeit klar ist, bevor Sie das nächste Lösungsmittel hinzufügen.
2. Achten Sie darauf, das/die Lösungsmittel der Reihe nach hinzuzufügen. Sie müssen sicherstellen, dass die bei der vorherigen Zugabe erhaltene Lösung eine klare Lösung ist, bevor Sie mit der Zugabe des nächsten Lösungsmittels fortfahren. Physikalische Methoden wie Vortex, Ultraschall oder ein heißes Wasserbad können zur Unterstützung des Lösens verwendet werden.
Wirkmechanismus
| Merkmale |
A potent, selective, and orally available inhibitor of PI3Kα, β, δ, γ and mTOR.
|
|---|---|
| Targets/IC50/Ki |
p110α
(Cell-free assay) 5 nM
p110δ
(Cell-free assay) 7 nM
p110γ
(Cell-free assay) 14 nM
mTOR
(Cell-free assay) 17 nM(Ki app)
p110β
(Cell-free assay) 27 nM
|
| In vitro |
Apitolisib (GDC-0980) zeigt potente und selektive inhibitorische Aktivitäten gegen Klasse I PI3K- und mTOR-Kinasen im Vergleich zu einer großen Auswahl an Kinasen, mit einem Ki von 17 nM für mTOR und IC50-Werten von 5 nM, 27 nM, 7 nM und 14 nM für PI3Kα, β, δ und γ. In vitro hemmt diese Verbindung die Zellproliferation in PC3- und MCF7-Zellen signifikant mit IC50-Werten von 307 nM bzw. 255 nM. Eine aktuelle Studie zeigt, dass es die Viabilität von Krebszellen reduziert, indem es die Zellzyklusprogression hemmt und Apoptose induziert, mit der größten Wirksamkeit bei Prostata- (IC50 < 200 nM 50%, <500 nM 100%), Brust- (IC50 <200 nM 37%, <500 nM 78%) und NSCLC-Linien (IC50 <200 nM 29%, <500 nM 88%) und geringerer Wirksamkeit bei Pankreas- (IC50 <200 nM 13%, <500 nM 67%) und Melanom-Zelllinien (IC50 <200 nM 0%, <500 nM 33%).
|
| Kinase-Assay |
Enzymatische Aktivität
|
|
Apitolisib (GDC-0980) wird mittels enzymatischer Aktivitätstests für die Klasse I PI3K-Isoformen bewertet, wobei eine Fluoreszenzpolarisationsmethode verwendet wird, die die Bildung von 3,4,5-Inositoltriphosphat überwacht, welches mit fluoreszenzmarkiertem PIP3 um die Bindung an das GRP-1-Pleckstrin-Homologie-Domänenprotein konkurriert. Eine Zunahme des Phosphatidylinositid-3-Phosphat-Produkts führt zu einer Abnahme des Fluoreszenzpolarisationssignals, da der markierte Fluorophor aus der GRP-1-Proteinbindungsstelle verdrängt wird. Klasse I PI3K-Isoformen werden als heterodimere rekombinante Proteine exprimiert und gereinigt. PI3K-Isoformen werden unter Anfangsratenbedingungen in Anwesenheit von 10 mM Tris (pH 7,5), 25 μM ATP, 9,75 μM PIP2, 5% Glycerin, 4 mM MgCl2, 50 mM NaCl, 0,05% (v/v) Chaps, 1 mM Dithiothreitol, 2% (v/v) DMSO in folgenden Konzentrationen für jede Isoform getestet: PI3Kα,β bei 60 ng/mL; PI3Kγ bei 8 ng/mL; PI3Kδ bei 45 ng/mL. Nach 30-minütigem Test bei 25°C werden die Reaktionen mit einer Endkonzentration von 9 mM EDTA, 4,5 nM TAMRA-PIP3 und 4,2 μg/mL GRP-1-Detektorprotein beendet, bevor die Fluoreszenzpolarisation auf einem Envision-Plattenlesegerät abgelesen wird. Die IC50-Werte werden aus der Anpassung der Dosis-Wirkungs-Kurven an eine 4-Parameter-Gleichung berechnet. Humanes rekombinantes mTOR(1360−2549) wird aus Insektenzellen exprimiert und gereinigt und mittels eines Lanthascreen-Fluoreszenzresonanzenergietransferformats getestet, bei dem die Phosphorylierung des rekombinanten grün fluoreszierenden Proteins (GFP)-4-EBP1 unter Verwendung eines Terbium-markierten Antikörpers gegen Phospho-Threonin 37/46 von 4-EBP1 nachgewiesen wird. Die Reaktionen werden mit ATP initiiert und in Anwesenheit von 50 mM Hepes (pH 7,5), 0,25 nM mTOR, 400 nM GFP-4E-BP1, 8 μM ATP, 0,01% (v/v) Tween 20, 10 mM MnCl2, 1 mM EGTA, 1 mM Dithiothreitol und 1% (v/v) DMSO durchgeführt. Die Tests werden unter Anfangsratenbedingungen bei Raumtemperatur für 30 Minuten durchgeführt, bevor die Reaktion beendet und das Produkt in Anwesenheit von 2 nM Tb-anti-p4E-BP1-Antikörper und 10 mM EDTA nachgewiesen wird. Dosis-Wirkungs-Kurven werden an eine Gleichung für die kompetitive feste Bindungshemmung angepasst und scheinbare Ki's werden unter Verwendung des bestimmten Km für ATP von 6,1 μM berechnet.
|
|
| In vivo |
Apitolisib (GDC-0980) zeigt bei einer Dosis von 1 mg/kg eine signifikante Antitumoraktivität, indem es in PC-3- und MCF-7 neo/HER2-Xenograftmodellen das Tumorwachstum verzögert. Darüber hinaus führt diese Verbindung bei der maximal tolerierten Dosis von 7,5 mg/kg zu Tumorstase oder Regressionen. Bei Mäusen führt die intravenöse Verabreichung von 1 mg/kg zu einer geringen Clearance (Clp: 9,2 ml/min/kg, Vss: 1,7 l/kg). Während die orale Verabreichung von 5 mg/kg in 80% PEG400 und von 50 mg/kg als kristalline Suspension in 0,5% Methylcellulose/0,2% Tween-80 ebenfalls zu günstigen pharmakokinetischen Parametern führt.
|
Literatur |
|
Anwendungen
| Methoden | Biomarker | Bilder | PMID |
|---|---|---|---|
| Growth inhibition assay | Cell viability |
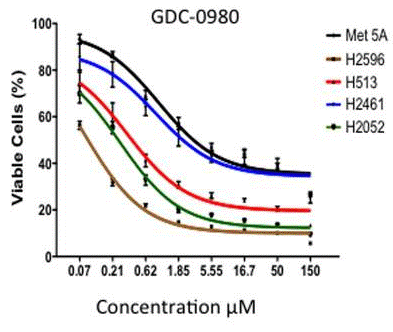
|
25221930 |
| Western blot | p-AKT / AKT / p-S6RP / S6RP / p-4EBP / 4EBP / p-eNOS / eNOS |
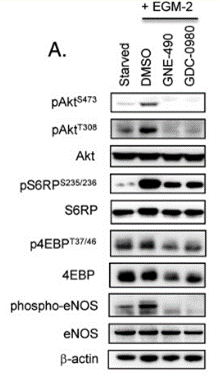
|
23814482 |
Klinische Studieninformationen
(Daten von https://clinicaltrials.gov, aktualisiert am 2024-05-22)
| NCT-Nummer | Rekrutierung | Erkrankungen | Sponsor/Kooperationspartner | Startdatum | Phasen |
|---|---|---|---|---|---|
| NCT01487239 | Completed | Healthy Volunteer |
Genentech Inc. |
December 2011 | Phase 1 |
| NCT01455493 | Completed | Endometrial Carcinoma |
Genentech Inc. |
December 2011 | Phase 2 |
| NCT01442090 | Completed | Renal Cell Carcinoma |
Genentech Inc. |
October 2011 | Phase 2 |
| NCT01254526 | Completed | Breast Cancer |
Genentech Inc. |
December 2010 | Phase 1 |
| NCT00854126 | Completed | Non-Hodgkin''s Lymphoma Solid Cancers |
Genentech Inc. |
May 2009 | Phase 1 |
| NCT00854152 | Completed | Non-Hodgkin''s Lymphoma Solid Cancers |
Genentech Inc. |
March 2009 | Phase 1 |
Technischer Support
Tel: +1-832-582-8158 Ext:3
Wenn Sie weitere Fragen haben, hinterlassen Sie bitte eine Nachricht.
