nur für Forschungszwecke
Ritonavir HIV Protease Inhibitor
Kat.-Nr.S1185
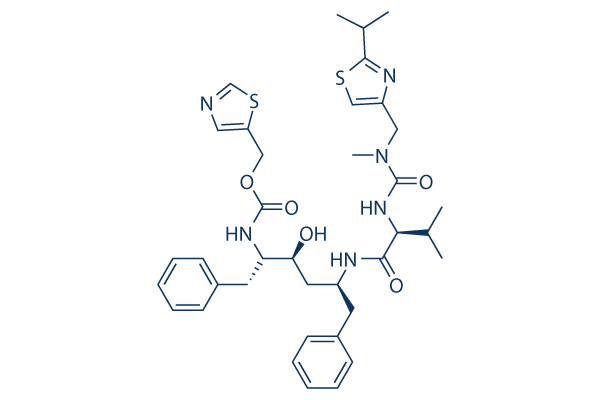
Chemische Struktur
Molekulargewicht: 720.94
Qualitätskontrolle
| Verwandte Ziele | HDAC Caspase Proteasome Secretase MMP HCV Protease Cysteine Protease DPP Tyrosinase Serine Protease |
|---|---|
| Weitere HIV Protease Inhibitoren | Pepstatin A Limonin Temsavir (BMS-626529) NBD-556 Bevirimat GS-6207 Rosamultin Dextran sulfate sodium (DSS) Mericitabine Azvudine |
Chemische Informationen, Lagerung & Stabilität
| Molekulargewicht | 720.94 | Formel | C37H48N6O5S2 |
Lagerung (Ab dem Eingangsdatum) | |
|---|---|---|---|---|---|
| CAS-Nr. | 155213-67-5 | SDF herunterladen | Lagerung von Stammlösungen |
|
|
| Synonyme | ABT-538,A 84538, RTV | Smiles | CC(C)C(NC(=O)N(C)CC1=CSC(=N1)C(C)C)C(=O)NC(CC(O)C(CC2=CC=CC=C2)NC(=O)OCC3=CN=CS3)CC4=CC=CC=C4 | ||
Löslichkeit
|
In vitro |
DMSO
: 100 mg/mL
(138.7 mM)
Ethanol : 100 mg/mL Water : Insoluble |
Molaritätsrechner
|
In vivo |
|||||
In-vivo-Formulierungsrechner (Klare Lösung)
Schritt 1: Geben Sie die untenstehenden Informationen ein (Empfohlen: Ein zusätzliches Tier zur Berücksichtigung von Verlusten während des Experiments)
Schritt 2: Geben Sie die In-vivo-Formulierung ein (Dies ist nur der Rechner, keine Formulierung. Bitte kontaktieren Sie uns zuerst, wenn es im Abschnitt "Löslichkeit" keine In-vivo-Formulierung gibt.)
Berechnungsergebnisse:
Arbeitskonzentration: mg/ml;
Methode zur Herstellung der DMSO-Stammlösung: mg Wirkstoff vorgelöst in μL DMSO ( Konzentration der Stammlösung mg/mL, Bitte kontaktieren Sie uns zuerst, wenn die Konzentration die DMSO-Löslichkeit der Wirkstoffcharge überschreitet. )
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügenμL PEG300, mischen und klären, dann hinzufügenμL Tween 80, mischen und klären, dann hinzufügen μL ddH2O, mischen und klären.
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügen μL Maisöl, mischen und klären.
Hinweis: 1. Bitte stellen Sie sicher, dass die Flüssigkeit klar ist, bevor Sie das nächste Lösungsmittel hinzufügen.
2. Achten Sie darauf, das/die Lösungsmittel der Reihe nach hinzuzufügen. Sie müssen sicherstellen, dass die bei der vorherigen Zugabe erhaltene Lösung eine klare Lösung ist, bevor Sie mit der Zugabe des nächsten Lösungsmittels fortfahren. Physikalische Methoden wie Vortex, Ultraschall oder ein heißes Wasserbad können zur Unterstützung des Lösens verwendet werden.
Wirkmechanismus
| Targets/IC50/Ki |
CYP3A4
HIV
|
|---|---|
| In vitro |
Ritonavir ist ein sehr potenter Inhibitor der CYP3A4-vermittelten Testosteron-6β-Hydroxylierung mit einem mittleren Ki von 19 nM und hemmt auch die Tolbutamid-Hydroxylierung mit einem IC50 von 4,2 μM. Diese Verbindung ist ein potenter Inhibitor von CYP3A-vermittelten Biotransformationen (Nifedipinoxidation mit IC50 von 0,07 mM, 17alpha-Ethinylestradiol-2-Hydroxylierung mit IC50 von 2 mM; Terfenadin-Hydroxylierung mit IC50 von 0,14 mM). Es ist auch ein Inhibitor der Reaktionen, die durch CYP2D6 (IC50 = 2,5 mM) und CYP2C9/10 (IC50 = 8,0 mM) vermittelt werden. Dieses Mittel führt zu einer Erhöhung der Zelllebensfähigkeit in uninfizierten menschlichen PBMC-Kulturen. Es verringert die Anfälligkeit von PBMCs für Apoptosis deutlich, korreliert mit niedrigeren Kaspase-1-Expressionsspiegeln, Abnahmen der Annexin-V-Färbung und reduziert die Kaspase-3-Aktivität in uninfizierten menschlichen PBMC-Kulturen. Die Verbindung hemmt die Induktion der Tumornekrosefaktor (TNF)-Produktion durch PBMCs und Monozyten zeit- und dosisabhängig in nicht-toxischen Konzentrationen. Es hemmt die p-Glykoprotein-vermittelte Extrusion von Saquinavir mit einem IC50 von 0,2 μM, was auf eine hohe Affinität von Ritonavir für p-Glykoprotein hinweist. Diese Chemikalie hemmt den humanen Lebermikrosomenstoffwechsel von ABT-378 potent mit einem Ki von 13 nM. In Kombination mit ABT-378 (im Verhältnis 3:1 und 29:1) hemmt es CYP3A (IC50 = 1,1 und 4,6 μM), wenn auch weniger potent als Ritonavir (IC50 = 0,14 μM). |
Literatur |
|
Klinische Studieninformationen
(Daten von https://clinicaltrials.gov, aktualisiert am 2024-05-22)
| NCT-Nummer | Rekrutierung | Erkrankungen | Sponsor/Kooperationspartner | Startdatum | Phasen |
|---|---|---|---|---|---|
| NCT06397144 | Not yet recruiting | Biological Availability|Healthy Participants |
Pfizer |
February 14 2025 | Phase 1 |
| NCT06139796 | Not yet recruiting | HIV Infections |
PENTA Foundation|AMS-PHPT Research Collaboration|Institut National de la Santé Et de la Recherche Médicale France|Centre Mère et Enfant de la Fondation Chantal Biya|Centre Hospitalier National d''Enfants Albert Royer|University of Zimbabwe Clinical Research Centre (UZCRC)|Baylor College of Medicine |
June 2024 | Phase 1|Phase 2 |
| NCT05953545 | Not yet recruiting | Chronic Hepatitis Delta |
National Institute of Diabetes and Digestive and Kidney Diseases (NIDDK)|National Institutes of Health Clinical Center (CC) |
May 15 2024 | Phase 2 |
| NCT06291831 | Active not recruiting | COVID-19 |
Pfizer |
March 13 2024 | -- |
| NCT06085924 | Recruiting | COVID-19 |
Pfizer |
November 14 2023 | -- |
| NCT06016556 | Completed | Covid-19 |
Pfizer |
October 17 2023 | -- |
Technischer Support
Tel: +1-832-582-8158 Ext:3
Wenn Sie weitere Fragen haben, hinterlassen Sie bitte eine Nachricht.
