nur für Forschungszwecke
ZSTK474 PI3K Inhibitor
Kat.-Nr.S1072
Chemische Struktur
Molekulargewicht: 417.41
Qualitätskontrolle
| Verwandte Ziele | Akt mTOR GSK-3 ATM/ATR DNA-PK AMPK PDPK1 PTEN PP2A PDK |
|---|---|
| Weitere PI3K Inhibitoren | GDC-0077 (Inavolisib) SAR405 Quercetin (Sophoretin) LY294002 XL147 analogue Tersolisib (STX-478) Buparlisib (BKM120) 740 Y-P (PDGFR 740Y-P) GO-203 TFA Eganelisib (IPI-549) |
Zellkultur, Behandlung & Arbeitskonzentration
| Zelllinien | Assay-Typ | Konzentration | Inkubationszeit | Formulierung | Aktivitätsbeschreibung | PMID |
|---|---|---|---|---|---|---|
| Sf21 insect cells | Function assay | 1 h | Inhibition of bovine recombinant PI3K p110delta expressed in Sf21 insect cells using phosphatidylinositol as substrate after 1 hr by phosphoimaging, IC50=0.7 nM | |||
| human HCT116 cells | Function assay | 15 mins | Inhibition of PIK3CA H1047R mutant-mediated cell signaling in human HCT116 cells expressing PTEN assessed as inhibition of insulin-induced pAkt/PKB phosphorylation at Thr308 treated for 15 mins before insulin challenge measured after 5 mins by immunoblotting, IC50=78 nM | |||
| human LNCAP cells | Proliferation assay | 3 days | Antiproliferative activity against human LNCAP cells after 3 days by MTS assay, IC50=0.21 μM | |||
| human NZB5 cells | Proliferation assay | 5 days | Antiproliferative activity against human NZB5 cells expressing wild type p110alpha assessed as incorporation of [3H]thymidine after 5 days, IC50=0.22 μM | |||
| human NZOV9 cells | Proliferation assay | 5 days | Antiproliferative activity against human NZOV9 cells expressing p110alpha kinase Y1021C mutant assessed as incorporation of [3H]thymidine after 5 days, IC50=0.29 μM | |||
| human MDA-MB-468 cells | Cytotoxic assay | 48 h | Cytotoxicity against PTEN-deficient human MDA-MB-468 cells assessed as inhibition of cell growth after 48 hrs by Cell Titer 96 assay | |||
| human A549 cells | Function assay | 10 μM | 1 h | Inhibition of PI3K in human A549 cells assessed as reduction in pAkt level at 10 uM after 1 hr by Western blotting analysis | ||
| human DMS114 cells | Growth inhibition assay | Growth inhibition of human DMS114 cells | ||||
| human MKN74 cells | Growth inhibition assay | Growth inhibition of human MKN74 cells | ||||
| human SNB78 cells | Growth inhibition assay | Growth inhibition of human SNB78 cells | ||||
| human St-4 cells | Growth inhibition assay | Growth inhibition of human St-4 cells | ||||
| human DU145 cells | Growth inhibition assay | Growth inhibition of human DU145 cells | ||||
| human LOXIMVI cells | Growth inhibition assay | Growth inhibition of human LOXIMVI cells | ||||
| human PC3 cells | Growth inhibition assay | Growth inhibition of human PC3 cells | ||||
| human LOXIMVI cells | Growth inhibition assay | Growth inhibition of human LOXIMVI cells | ||||
| human OVCAR3 cells | Growth inhibition assay | Growth inhibition of human OVCAR3 cells | ||||
| human SKOV3 cells | Growth inhibition assay | Growth inhibition of human SKOV3 cells | ||||
| human KM12 cells | Growth inhibition assay | Growth inhibition of human KM12 cells | ||||
| human HT-29 cells | Growth inhibition assay | Growth inhibition of human HT-29 cells | ||||
| human HCT15 cells | Growth inhibition assay | Growth inhibition of human HCT15 cells | ||||
| human NCI-H226 cells | Growth inhibition assay | Growth inhibition of human NCI-H226 cells | ||||
| human NCI-H522 cells | Growth inhibition assay | Growth inhibition of human NCI-H522 cells | ||||
| human A549 cells | Growth inhibition assay | Growth inhibition of human A549 cells | ||||
| human HCC2998 cells | Growth inhibition assay | Growth inhibition of human HCC2998 cells | ||||
| human SNB75 cells | Growth inhibition assay | Growth inhibition of human SNB75 cells | ||||
| human OVCAR4 cells | Growth inhibition assay | Growth inhibition of human OVCAR4 cells | ||||
| human OVCAR5 cells | Growth inhibition assay | Growth inhibition of human OVCAR5 cells | ||||
| human OVCAR8 cells | Growth inhibition assay | Growth inhibition of human OVCAR8 cells | ||||
| human SKOV3 cells | Growth inhibition assay | Growth inhibition of human SKOV3 cells | ||||
| human ACHN cells | Growth inhibition assay | Growth inhibition of human ACHN cells | ||||
| Klicken Sie hier, um weitere experimentelle Daten zu Zelllinien anzuzeigen | ||||||
Chemische Informationen, Lagerung & Stabilität
| Molekulargewicht | 417.41 | Formel | C19H21F2N7O2 |
Lagerung (Ab dem Eingangsdatum) | |
|---|---|---|---|---|---|
| CAS-Nr. | 475110-96-4 | SDF herunterladen | Lagerung von Stammlösungen |
|
|
| Synonyme | N/A | Smiles | C1COCCN1C2=NC(=NC(=N2)N3C4=CC=CC=C4N=C3C(F)F)N5CCOCC5 | ||
Löslichkeit
|
In vitro |
DMSO
: 15 mg/mL
(35.93 mM)
Water : Insoluble Ethanol : Insoluble |
Molaritätsrechner
|
In vivo |
|||||
In-vivo-Formulierungsrechner (Klare Lösung)
Schritt 1: Geben Sie die untenstehenden Informationen ein (Empfohlen: Ein zusätzliches Tier zur Berücksichtigung von Verlusten während des Experiments)
Schritt 2: Geben Sie die In-vivo-Formulierung ein (Dies ist nur der Rechner, keine Formulierung. Bitte kontaktieren Sie uns zuerst, wenn es im Abschnitt "Löslichkeit" keine In-vivo-Formulierung gibt.)
Berechnungsergebnisse:
Arbeitskonzentration: mg/ml;
Methode zur Herstellung der DMSO-Stammlösung: mg Wirkstoff vorgelöst in μL DMSO ( Konzentration der Stammlösung mg/mL, Bitte kontaktieren Sie uns zuerst, wenn die Konzentration die DMSO-Löslichkeit der Wirkstoffcharge überschreitet. )
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügenμL PEG300, mischen und klären, dann hinzufügenμL Tween 80, mischen und klären, dann hinzufügen μL ddH2O, mischen und klären.
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügen μL Maisöl, mischen und klären.
Hinweis: 1. Bitte stellen Sie sicher, dass die Flüssigkeit klar ist, bevor Sie das nächste Lösungsmittel hinzufügen.
2. Achten Sie darauf, das/die Lösungsmittel der Reihe nach hinzuzufügen. Sie müssen sicherstellen, dass die bei der vorherigen Zugabe erhaltene Lösung eine klare Lösung ist, bevor Sie mit der Zugabe des nächsten Lösungsmittels fortfahren. Physikalische Methoden wie Vortex, Ultraschall oder ein heißes Wasserbad können zur Unterstützung des Lösens verwendet werden.
Wirkmechanismus
| Merkmale |
First orally administered PI3K inhibitor used in vivo.
|
|---|---|
| Targets/IC50/Ki |
PI3Kδ
(Cell-free assay) 4.6 nM
PI3Kα
(Cell-free assay) 16 nM
PI3K
(Cell-free assay) 37 nM
PI3Kβ
(Cell-free assay) 44 nM
PI3Kγ
(Cell-free assay) 49 nM
|
| In vitro |
ZSTK474 reduziert bei 1 μM die PI3K-Aktivität potent auf 4,7 % des Kontrollniveaus, während LY2194002 die Aktivität nur auf 44,6 % der Kontrolle reduziert. Diese Verbindung hemmt die Aktivitäten von rekombinantem p110β, -γ und -δ mit IC50-Werten von 17 nM, 53 nM bzw. 6 nM. Sie zeigt eine potente antiproliferative Aktivität gegen eine Reihe von 39 menschlichen Krebszelllinien mit einem mittleren GI50 von 0,32 μM, effektiver als die von LY294002 oder Wortmannin mit einem mittleren GI50 von 7,4 μM bzw. 10 μM. Diese chemische Behandlung bei 1 μM blockiert die Membranrüschenbildung und die PIP3-Generierung, die durch den aus Blutplättchen stammenden Wachstumsfaktor in murinen embryonalen Fibroblasten (MEFs) induziert werden. Bei 10 μM induziert sie Apoptose in OVCAR3-Zellen und induziert einen vollständigen G1-Phasenarrest, aber keine Apoptose in A549-Zellen. Diese Verbindungsbehandlung bei 0,5 μM verringert signifikant den Spiegel von phosphoryliertem Akt und GSK-3β sowie die Cyclin D1-Proteinexpression. Sie hemmt auch die Phosphorylierung anderer nachgeschalteter Signalgebungskomponenten, die an der Regulierung der Zellproliferation beteiligt sind, einschließlich FKHRL1, FKHR, TSC-2, mTOR und p70S6K, in einer dosisabhängigen Weise. Diese Chemikalie hemmt mTOR bei 0,1 μM nicht, und selbst bei einer Konzentration von 100 μM hemmt sie die mTOR-Aktivität um weniger als 40 %. Sie blockiert VEGF-induzierte Zellmigration und die Röhrenbildung in humanen Nabelvenenendothelzellen (HUVECs) und hemmt die Expression von HIF-1α und die Sekretion von VEGF in RXF-631L-Zellen, wobei sie eine potente In-vitro-antiangiogene Aktivität aufweist. Diese Verbindungsbehandlung hemmt die Produktion von IFNγ und IL-17 in Concanavalin A-aktivierten T-Zellen und hemmt die Proliferation und PGE(2)-Produktion durch fibroblastenähnliche Synovialzellen (FLS). |
| Kinase-Assay |
Hemmung der PI3K-Aktivität
|
|
A549-Zellen werden in einem Puffer, der 20 mM Tris-HCl (pH 7,5), 150 mM NaCl, 5 mM EDTA und 1 % Igepal CA-630 enthält, lysiert, die Lysate werden 10 Minuten lang bei 20.000 g und 4 °C zentrifugiert, und die Überstände werden als Zelllysat (Protein = 2-4 mg/mL) verwendet. Zur Immunpräzipitation von PI3K werden 200 μL Zelllysat mit anti-p85 polyklonalem Antikörper und Protein G-Agarose (5 μL) inkubiert. PI3Kα, PI3Kβ und PI3Kδ können durch den anti-p85 polyklonalen Antikörper immunpräzipitiert werden. Agarose-Kügelchen, die Immunpräzipitate enthalten, werden zweimal mit Puffer A (20 mM Tris-HCl bei pH 7,5, 150 mM NaCl, 5 mM EDTA und 1 % Igepal CA-630), einmal mit Puffer B (500 mM LiCl und 100 mM Tris-HCl bei pH 7,5), einmal mit destilliertem Wasser und einmal mit Puffer C (100 mM NaCl und 20 mM Tris-HCl bei pH 7,5) gewaschen. Immunpräzipitate werden in 20 μL Puffer C, der Phosphatidylinositol von 200 μg/mL enthält, suspendiert. Die Mischung wird 5 Minuten lang bei 25 °C mit steigenden Konzentrationen dieser Verbindung vorinkubiert. [γ-32P]ATP (2 μCi pro Assay-Mischung; Endkonzentration, 20 μM) und MgCl2 (Endkonzentration, 20 mM) werden hinzugefügt, um die Reaktion zu starten. Die Reaktionsmischung wird 20 Minuten lang bei 25 °C inkubiert. Phosphorylierte Produkte von Phosphatidylinositol werden durch Dünnschichtchromatographie getrennt und durch Autoradiographie sichtbar gemacht. Die Phosphatidylinositol-3-Phosphat-Region wird von der Platte abgekratzt, und die Radioaktivität wird auch mit Flüssigszintillationsspektroskopie gemessen. Der Hemmungsgrad für diese Chemikalie wird als Prozentsatz der 32P-Zählungen pro Minute bestimmt, die ohne diese Verbindung erhalten wurden.
|
|
| In vivo |
Die orale Verabreichung von ZSTK474 hemmt das Wachstum von subkutan implantierten Maus-B16F10-Melanomtumoren dosisabhängig und führt zu einer Tumorregression von 28,5 %, 7,1 % oder 4,9 % am Tag 14 bei 100, 200 oder 400 mg/kg, was der von vier großen Krebsmedikamenten bei ihren jeweiligen maximal verträglichen Dosen mit einer Tumorregression von 96 %, 35,7 %, 24 % oder 68,3 % überlegen ist. Diese Verbindungsbehandlung bei 400 mg/kg hemmt das Wachstum von A549-, PC-3- und WiDr-Xenotransplantaten bei Mäusen vollständig und induziert die Regression von A549-Xenotransplantattumoren. Sie hemmt das Tumorwachstum im RXF-631L-Xenotransplantatmodell signifikant, korreliert mit einer signifikant reduzierten Anzahl von Mikrogefäßen in den behandelten Mäusen. Die orale Verabreichung dieser Chemikalie lindert das Fortschreiten der adjuvant-induzierten Arthritis (AIA) bei Ratten.
|
Literatur |
|
Anwendungen
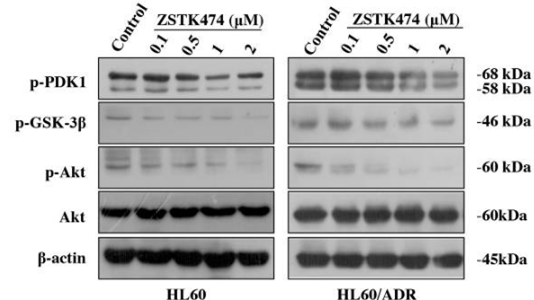
| Methoden | Biomarker | Bilder | PMID |
|---|---|---|---|
| Western blot | p-PDK1 / p-GSK3β / p-AKT / AKT P-gp / MRP1 p-Rb / p27 / Cyclin D1 HIF-1α / HIF-1β |
|
28388564 |
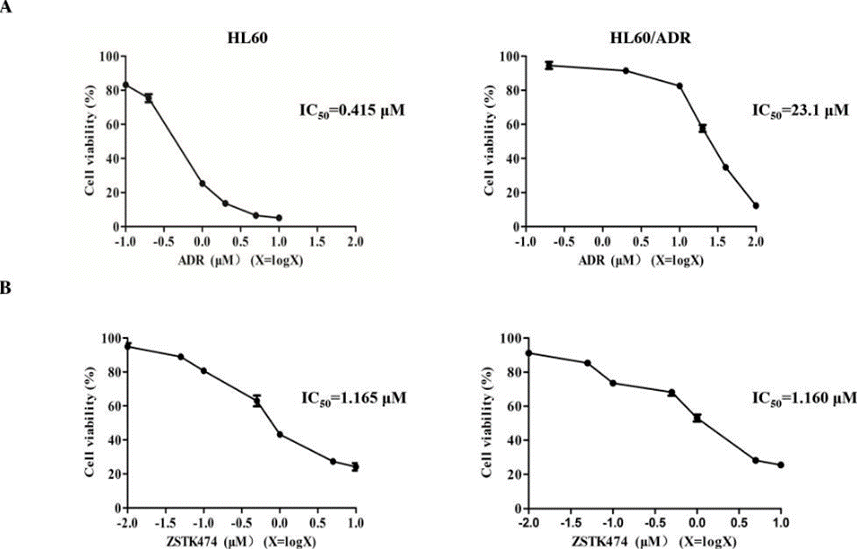
| Growth inhibition assay | Cell viability |
|
28388564 |
Technischer Support
Tel: +1-832-582-8158 Ext:3
Wenn Sie weitere Fragen haben, hinterlassen Sie bitte eine Nachricht.
