nur für Forschungszwecke
A66 PI3K Inhibitor
Kat.-Nr.S2636
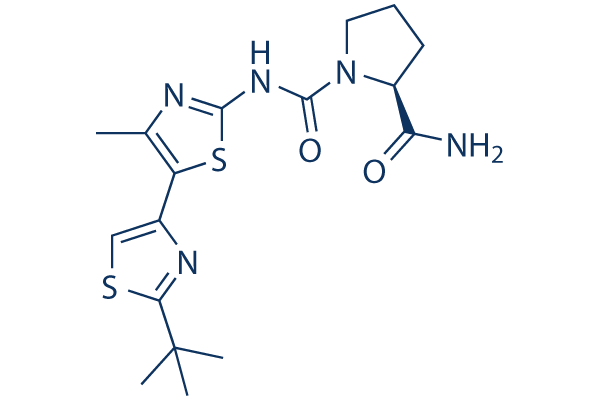
Chemische Struktur
Molekulargewicht: 393.53
Qualitätskontrolle
| Verwandte Ziele | Akt mTOR GSK-3 ATM/ATR DNA-PK AMPK PDPK1 PTEN PP2A PDK |
|---|---|
| Weitere PI3K Inhibitoren | GDC-0077 (Inavolisib) SAR405 Quercetin (Sophoretin) LY294002 XL147 analogue Tersolisib (STX-478) Buparlisib (BKM120) 740 Y-P (PDGFR 740Y-P) GO-203 TFA Eganelisib (IPI-549) |
Chemische Informationen, Lagerung & Stabilität
| Molekulargewicht | 393.53 | Formel | C17H23N5O2S2 |
Lagerung (Ab dem Eingangsdatum) | |
|---|---|---|---|---|---|
| CAS-Nr. | 1166227-08-2 | SDF herunterladen | Lagerung von Stammlösungen |
|
|
| Synonyme | N/A | Smiles | CC1=C(SC(=N1)NC(=O)N2CCCC2C(=O)N)C3=CSC(=N3)C(C)(C)C | ||
Löslichkeit
|
In vitro |
DMSO
: 79 mg/mL
(200.74 mM)
Ethanol : 1 mg/mL Water : Insoluble |
Molaritätsrechner
|
In vivo |
|||||
In-vivo-Formulierungsrechner (Klare Lösung)
Schritt 1: Geben Sie die untenstehenden Informationen ein (Empfohlen: Ein zusätzliches Tier zur Berücksichtigung von Verlusten während des Experiments)
Schritt 2: Geben Sie die In-vivo-Formulierung ein (Dies ist nur der Rechner, keine Formulierung. Bitte kontaktieren Sie uns zuerst, wenn es im Abschnitt "Löslichkeit" keine In-vivo-Formulierung gibt.)
Berechnungsergebnisse:
Arbeitskonzentration: mg/ml;
Methode zur Herstellung der DMSO-Stammlösung: mg Wirkstoff vorgelöst in μL DMSO ( Konzentration der Stammlösung mg/mL, Bitte kontaktieren Sie uns zuerst, wenn die Konzentration die DMSO-Löslichkeit der Wirkstoffcharge überschreitet. )
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügenμL PEG300, mischen und klären, dann hinzufügenμL Tween 80, mischen und klären, dann hinzufügen μL ddH2O, mischen und klären.
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügen μL Maisöl, mischen und klären.
Hinweis: 1. Bitte stellen Sie sicher, dass die Flüssigkeit klar ist, bevor Sie das nächste Lösungsmittel hinzufügen.
2. Achten Sie darauf, das/die Lösungsmittel der Reihe nach hinzuzufügen. Sie müssen sicherstellen, dass die bei der vorherigen Zugabe erhaltene Lösung eine klare Lösung ist, bevor Sie mit der Zugabe des nächsten Lösungsmittels fortfahren. Physikalische Methoden wie Vortex, Ultraschall oder ein heißes Wasserbad können zur Unterstützung des Lösens verwendet werden.
Wirkmechanismus
| Merkmale |
Highly selective for the p110α isoform.
|
|---|---|
| Targets/IC50/Ki |
p110α
(Cell-free assay) 32 nM
PI4Kβ
(Cell-free assay) 236 nM
C2β
(Cell-free assay) 462 nM
p110δ
(Cell-free assay) >1.25 μM
|
| In vitro |
Zusätzlich zum Wildtyp-p110α hemmt A66 auch die onkogenen Formen von p110α wie p110α E545K und p110α H1047R potent mit IC50 von 30 nM bzw. 43 nM. Im Gegensatz zu PIK-75 zeigt diese Verbindung eine über 100-fache Selektivität für p110α gegenüber anderen PI3K-Isoformen der Klasse I. Unter den PI3Ks der Klasse II, PI3K der Klasse III und PI4Ks zeigt sie nur eine begrenzte Kreuzreaktivität mit der PI3K PI3KC2β der Klasse II und der PI4Kβ-Isoform von PI4K mit IC50 von 462 nM bzw. 236 nM. Diese Chemikalie zeigt keine hemmende Aktivität gegen andere Lipidkinasen oder die verwandten Kinasen DNA-PK und mTOR. Sie hat einen höheren Grad an Spezifität im Vergleich zu PIK-75, wenn sie bei 10 μM gegen zwei große Panels von 110 Proteinkinasen und 318 Kinasen getestet wird. Die alleinige Hemmung von p110α durch diese Verbindung ist ausreichend, um die Insulinsignalisierung zu Akt/PKB in bestimmten Zelllinien zu blockieren, die H1047R-Mutationen in PIK3CA aufweisen und hohe Spiegel an p110α und Klasse-Ia-PI3K-Aktivität besitzen. Ihre Behandlung bei 0,7 μM induziert eine Reduktion der Fokusbildung um 75-80% durch die hochtransformierenden p85α iSH2-Mutanten KS459delN, DKRMN-S560del und K379E und reduziert die Phosphorylierung von Akt an T308 durch alle p85-Mutanten.
|
| In vivo |
Eine Einzeldosis von A66 bei 100 mg/kg führt zu einer tiefgreifenden Reduktion der Phosphorylierung von Akt/PKB und p70 S6-Kinase, aber nicht von ERK, im SK-OV-3-Tumorgewebe in vivo sowohl 1 Stunde als auch 6 Stunden nach der Verabreichung. Diese Verbindung, dosiert mit 100 mg/kg einmal täglich (QD) für 21 Tage oder 75 mg/kg zweimal täglich (BID) für 16 Tage, führt zu einer signifikanten Verzögerung des Wachstums von SK-OV-3-Xenograft-Tumoren mit einem durchschnittlichen TGI von 45,9 % bzw. 29,9 %, was sogar größer ist als das, was durch den gut etablierten Pan-PI3K-Inhibitor BEZ-235 induziert wird. Die QD-Dosierung dieser Chemikalie im HCT-116-Xenograft-Modell führt auch zu einer signifikanten Reduktion des Tumorvolumens mit einem TGI von 77,2 %, aber zu einer nicht signifikanten Reduktion des Tumorvolumens im U87MG-Xenograft-Modell. Die Verabreichung dieses Agens in einer Dosis von 10 mg/kg an männliche CD1-Mäuse führt zu signifikanten Beeinträchtigungen im ITT (Insulin-Toleranztest) und GTT (Glukose-Toleranztest) sowie zu einem Anstieg der Glukoseproduktion während eines PTT (Pyruvat-Toleranztest), fast auf dem gleichen Niveau wie bei den Pan-PI3K-Inhibitoren.
|
Literatur |
|
Klinische Studieninformationen
(Daten von https://clinicaltrials.gov, aktualisiert am 2024-05-22)
| NCT-Nummer | Rekrutierung | Erkrankungen | Sponsor/Kooperationspartner | Startdatum | Phasen |
|---|---|---|---|---|---|
| NCT01046383 | Terminated | NON-SMALL CELL LUNG CANCER |
Immunotec Inc. |
June 2010 | Phase 3 |
Technischer Support
Tel: +1-832-582-8158 Ext:3
Wenn Sie weitere Fragen haben, hinterlassen Sie bitte eine Nachricht.
