nur für Forschungszwecke
Azilsartan Angiotensin Receptor Antagonist
Kat.-Nr.S3046
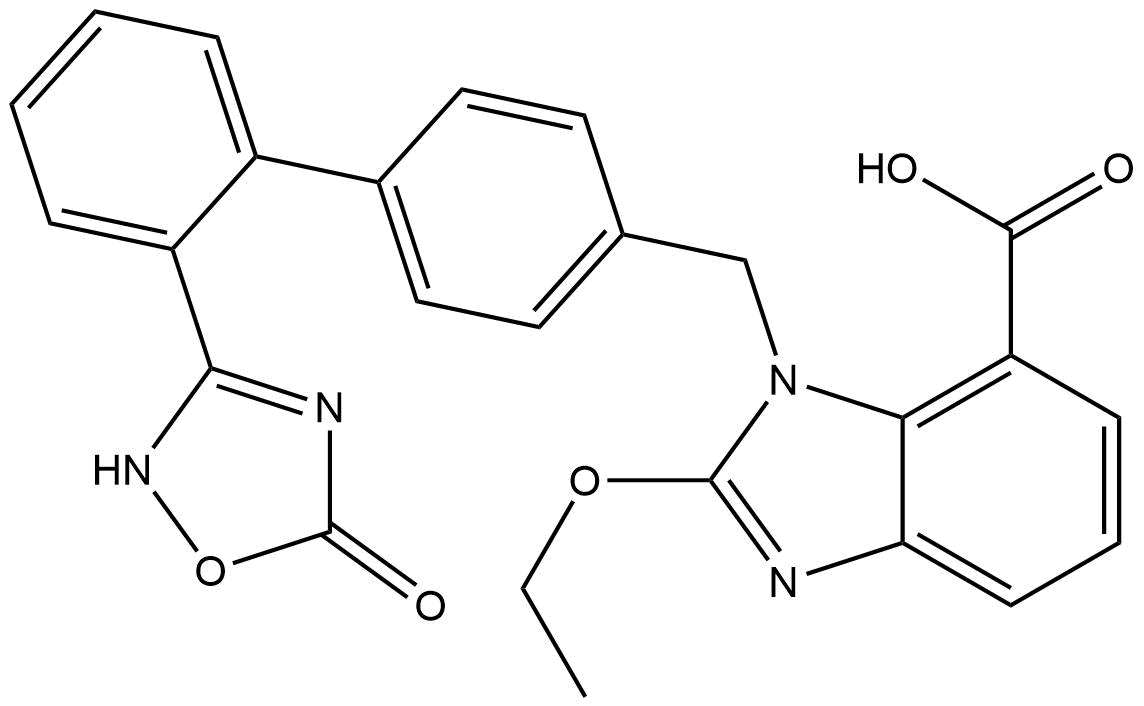
Chemische Struktur
Molekulargewicht: 456.45
Qualitätskontrolle
- In Nature Medicine für seine erstklassige Qualität zitiert
- COA
- NMR
- HPLC
- SDS
- Datenblatt
| Verwandte Ziele | CXCR Hedgehog/Smoothened PKA Adrenergic Receptor AChR 5-HT Receptor Histamine Receptor Dopamine Receptor Ras KRas |
|---|---|
| Weitere Angiotensin Receptor Inhibitoren | PD123319 ML221 A-779 Fimasartan Olodanrigan (EMA401) Buloxibutid AVE 0991 |
Chemische Informationen, Lagerung & Stabilität
| Molekulargewicht | 456.45 | Formel | C25H20N4O5 |
Lagerung (Ab dem Eingangsdatum) | |
|---|---|---|---|---|---|
| CAS-Nr. | 147403-03-0 | SDF herunterladen | Lagerung von Stammlösungen |
|
|
| Synonyme | TAK-536 | Smiles | CCOC1=NC2=CC=CC(=C2N1CC3=CC=C(C=C3)C4=CC=CC=C4C5=NOC(=O)N5)C(=O)O | ||
Löslichkeit
|
In vitro |
DMSO
: 91 mg/mL
(199.36 mM)
Water : Insoluble Ethanol : Insoluble |
Molaritätsrechner
|
In vivo |
|||||
In-vivo-Formulierungsrechner (Klare Lösung)
Schritt 1: Geben Sie die untenstehenden Informationen ein (Empfohlen: Ein zusätzliches Tier zur Berücksichtigung von Verlusten während des Experiments)
Schritt 2: Geben Sie die In-vivo-Formulierung ein (Dies ist nur der Rechner, keine Formulierung. Bitte kontaktieren Sie uns zuerst, wenn es im Abschnitt "Löslichkeit" keine In-vivo-Formulierung gibt.)
Berechnungsergebnisse:
Arbeitskonzentration: mg/ml;
Methode zur Herstellung der DMSO-Stammlösung: mg Wirkstoff vorgelöst in μL DMSO ( Konzentration der Stammlösung mg/mL, Bitte kontaktieren Sie uns zuerst, wenn die Konzentration die DMSO-Löslichkeit der Wirkstoffcharge überschreitet. )
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügenμL PEG300, mischen und klären, dann hinzufügenμL Tween 80, mischen und klären, dann hinzufügen μL ddH2O, mischen und klären.
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügen μL Maisöl, mischen und klären.
Hinweis: 1. Bitte stellen Sie sicher, dass die Flüssigkeit klar ist, bevor Sie das nächste Lösungsmittel hinzufügen.
2. Achten Sie darauf, das/die Lösungsmittel der Reihe nach hinzuzufügen. Sie müssen sicherstellen, dass die bei der vorherigen Zugabe erhaltene Lösung eine klare Lösung ist, bevor Sie mit der Zugabe des nächsten Lösungsmittels fortfahren. Physikalische Methoden wie Vortex, Ultraschall oder ein heißes Wasserbad können zur Unterstützung des Lösens verwendet werden.
Wirkmechanismus
| Merkmale |
A potent, orally active and specific AII receptor antagonist.
|
|---|---|
| Targets/IC50/Ki |
AT1 receptor
2.6 nM
|
| In vitro |
Azilsartan hemmt die spezifische Bindung von 125I-Sar1-Ile8-AII an menschliche Angiotensin-Typ-1-Rezeptoren. Diese Verbindung hemmt auch die Akkumulation von AII-induziertem Inositol-1-phosphat (IP1) im zellbasierten Assay mit einem IC50-Wert von 9,2 nM. In isolierten Kaninchenaortenstreifen reduziert es die maximale kontraktile Reaktion auf AII mit einem pD'2-Wert von 9,9. Die hemmenden Effekte dieser Chemikalie auf die durch AII induzierten kontraktilen Reaktionen bleiben nach dem Waschen der Streifen bestehen. Es unterdrückt den Anstieg des Plasmaglukosespiegels im oralen Glukosetoleranztest (OGTT) ohne signifikante Veränderung der Insulinkonzentration und verbesserte die Insulinsensitivität. Im Skelettmuskel verringert dieses Mittel die Expression von TNF-α bei Dosen von 0,001%. Im Fettgewebe reduziert es die TNF-α-Expression, erhöht jedoch die Expression von Adiponectin, PPARγ, C/EBα und aP2. In kultivierten 3T3-L1-Präadipozyten verbessert diese Verbindung die Adipogenese und übt stärkere Effekte als Valsartan auf die Expression von Genen aus, die den Peroxisom-Proliferator-aktivierten Rezeptor-α (PPARα), PPARδ, Leptin, Adipsin und Adiponectin kodieren. Es hemmt auch potent die Vaskularzellproliferation in Abwesenheit von exogen supplementiertem Angiotensin II.
|
| Kinase-Assay |
Radioligandenbindungsstudien an menschlichen AT1-Rezeptoren
|
|
Ein Radioligandenbindungsassay wird unter Verwendung von menschlichen AT1-Rezeptor-beschichteten Mikrotiterplatten durchgeführt, die 4,4 bis 6,2 fmol Rezeptoren/Well (10 μg Membranprotein/Well) enthalten. Membranbeschichtete Wells werden mit 45 μL Assaypuffer (50 mM Tris-HCl, 5 mM MgCl2, 1 mM EDTA und 0,005% CHAPS, pH 7,4) inkubiert, der verschiedene Konzentrationen von Azilsartan bei Raumtemperatur enthält. Nach 90 Minuten werden 5 μL 125I-Sar1-Ile8-AII (Endkonzentration 0,6 nM), gelöst in Assaypuffer, zu den Wells gegeben und die Platte 5 Stunden lang inkubiert. Bei jedem Schritt wird die Platte kurz und vorsichtig auf einem Plattenschüttler geschüttelt. In Auswaschexperimenten werden die Membranen 90 Minuten lang mit dieser Verbindung inkubiert, dann sofort zweimal mit 200 μL/Well Assaypuffer gewaschen, um ungebundene Verbindungen zu entfernen, und weitere 5 Stunden mit 125I-Sar1-Ile8-AII inkubiert. Die membrangebundene Radioaktivität wird mit einem TopCount Microplate Scintillation and Luminescence Counter gezählt. In den Experimenten zur Abschätzung der Dissoziationsrate dieser Chemikalie von AT1-Rezeptoren werden die Membranen 90 Minuten lang mit dieser Verbindung in einer Konzentration von 30 nM für diese Verbindung inkubiert. Diese Verbindung hemmt die spezifische Bindung von 125I-Sar1-Ile8-AII an menschliche AT1 um ca. 90%. Die Membranen werden dann sofort zweimal mit 200 μL/Well Assaypuffer gewaschen und weitere 240 Minuten mit 125I-Sar1-Ile8-AII inkubiert. Die membrangebundene Radioaktivität wird mit dem TopCount Microplate Scintillation and Luminescence Counter nach 30 Minuten, 60 Minuten, 90 Minuten, 120 Minuten, 150 Minuten, 180 Minuten oder 240 Minuten gezählt. Die unspezifische Bindung von 125I-Sar1-Ile8-AII wird in Gegenwart von 10 μM unmarkiertem AII geschätzt. Unmarkiertes AII wird nach dem Auswaschen für das Auswaschexperiment erneut hinzugefügt. Spezifische Bindung wird als Gesamtbindung minus unspezifische Bindung definiert.
|
|
| In vivo |
Bei Koletsky-Ratten senkt die Azilsartan-Behandlung den Blutdruck, die basale Plasma-Insulinkonzentration und den Homöostase-Modell-Assay des Insulinresistenzindex und hemmt eine übermäßige Zunahme der Plasma-Glukose- und Insulinkonzentrationen während des oralen Glukosetoleranztests. Diese Verbindung reguliert die Expression der 11β-Hydroxysteroid-Dehydrogenase Typ 1 herunter.
|
Literatur |
|
Klinische Studieninformationen
(Daten von https://clinicaltrials.gov, aktualisiert am 2024-05-22)
| NCT-Nummer | Rekrutierung | Erkrankungen | Sponsor/Kooperationspartner | Startdatum | Phasen |
|---|---|---|---|---|---|
| NCT04668157 | Completed | Hypertension |
Takeda |
May 17 2021 | Phase 3 |
| NCT03434977 | Completed | Healthy Volunteers |
Takeda |
February 14 2018 | Phase 1 |
| NCT03042299 | Completed | Japanese Healthy Adult Male Participants |
Takeda |
February 10 2017 | Phase 1 |
| NCT02791438 | Completed | Pediatric Hypertension |
Takeda |
August 18 2016 | Phase 3 |
| NCT02541669 | Completed | Healthy Volunteer |
Takeda |
November 20 2015 | Phase 1 |
| NCT02451150 | Completed | Pediatric Hypertension |
Takeda |
August 2015 | Phase 3 |
Technischer Support
Tel: +1-832-582-8158 Ext:3
Wenn Sie weitere Fragen haben, hinterlassen Sie bitte eine Nachricht.
