nur für Forschungszwecke
Macitentan Endothelin Receptor Antagonist
Kat.-Nr.S8051
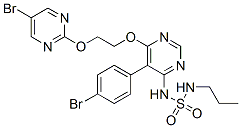
Chemische Struktur
Molekulargewicht: 588.27
Qualitätskontrolle
| Verwandte Ziele | CXCR Hedgehog/Smoothened PKA Adrenergic Receptor AChR 5-HT Receptor Histamine Receptor Dopamine Receptor Ras KRas |
|---|---|
| Weitere Endothelin Receptor Inhibitoren | BQ-123 Zibotentan (ZD4054) Sparsentan (PS-433540, RE-021) Carperitide Acetate Lu-135252 Pearl Extract Aprocitentan Atrasentan |
Chemische Informationen, Lagerung & Stabilität
| Molekulargewicht | 588.27 | Formel | C19H20Br2N6O4S |
Lagerung (Ab dem Eingangsdatum) | |
|---|---|---|---|---|---|
| CAS-Nr. | 441798-33-0 | SDF herunterladen | Lagerung von Stammlösungen |
|
|
| Synonyme | ACT 064992 | Smiles | CCCNS(=O)(=O)NC1=C(C(=NC=N1)OCCOC2=NC=C(C=N2)Br)C3=CC=C(C=C3)Br | ||
Löslichkeit
|
In vitro |
DMSO
: 100 mg/mL
(169.98 mM)
Water : Insoluble Ethanol : Insoluble |
Molaritätsrechner
|
In vivo |
|||||
In-vivo-Formulierungsrechner (Klare Lösung)
Schritt 1: Geben Sie die untenstehenden Informationen ein (Empfohlen: Ein zusätzliches Tier zur Berücksichtigung von Verlusten während des Experiments)
Schritt 2: Geben Sie die In-vivo-Formulierung ein (Dies ist nur der Rechner, keine Formulierung. Bitte kontaktieren Sie uns zuerst, wenn es im Abschnitt "Löslichkeit" keine In-vivo-Formulierung gibt.)
Berechnungsergebnisse:
Arbeitskonzentration: mg/ml;
Methode zur Herstellung der DMSO-Stammlösung: mg Wirkstoff vorgelöst in μL DMSO ( Konzentration der Stammlösung mg/mL, Bitte kontaktieren Sie uns zuerst, wenn die Konzentration die DMSO-Löslichkeit der Wirkstoffcharge überschreitet. )
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügenμL PEG300, mischen und klären, dann hinzufügenμL Tween 80, mischen und klären, dann hinzufügen μL ddH2O, mischen und klären.
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügen μL Maisöl, mischen und klären.
Hinweis: 1. Bitte stellen Sie sicher, dass die Flüssigkeit klar ist, bevor Sie das nächste Lösungsmittel hinzufügen.
2. Achten Sie darauf, das/die Lösungsmittel der Reihe nach hinzuzufügen. Sie müssen sicherstellen, dass die bei der vorherigen Zugabe erhaltene Lösung eine klare Lösung ist, bevor Sie mit der Zugabe des nächsten Lösungsmittels fortfahren. Physikalische Methoden wie Vortex, Ultraschall oder ein heißes Wasserbad können zur Unterstützung des Lösens verwendet werden.
Wirkmechanismus
| Targets/IC50/Ki |
ET-A
0.5 nM
ET-B
391 nM
|
|---|---|
| In vitro |
Macitentan erzielt eine vollständige Hemmung des durch ET-1 induzierten intrazellulären Kalziumanstiegs in primären menschlichen Lungenmuskelzellen mit einer approximativen IC50 von 1 nM. Diese Verbindung hemmt ET-1-induzierte Kontraktionen an isolierten Ratten-Aortenringen oder S6c-induzierte Kontraktionen an isolierten Ratten-Trachealringen mit pA2 von 7,6 bzw. 5,9.
|
| In vivo |
Macitentan, das normotensiven Ratten verabreicht wird, erhöht die Plasma-ET-1-Konzentration, was bei einer 10-fach niedrigeren Dosis als bei Bosentan auftrat. Diese Verbindung senkt dosisabhängig den mittleren arteriellen Blutdruck bei hypertensiven DOCA-Salzratten mit einem maximalen Effekt von -26 mm Hg bei einer Dosis von 10 mg/kg und einer ED50 von 1 mg/kg. Bei der maximal wirksamen Dosis beträgt die Dauer der Blutdruckreaktion auf diese Verbindung ungefähr 40 Stunden. Oral verabreicht, verhindert es dosisabhängig die Entwicklung von pulmonaler Hypertonie und die Entwicklung einer Rechtsherzhypertrophie mit einer maximalen Wirksamkeit von 30 mg/kg/Tag im Monocrotalin-Rattenmodell der pulmonalen Hypertonie. Die chronische orale Verabreichung dieser Chemikalie in einer Dosis von 30 mg/kg/Tag verbessert die 42-Tage-Überlebensrate bei Monocrotalin-Ratten signifikant (83 % vs. 50 % Überleben bei Macitentan vs. Vehikel; 66 % Reduktion der Mortalität nach 42 Tagen).
Diese Verbindung (30 mg/kg/Tag), die 24 h lang behandelt wurde, verhindert teilweise die Entwicklung einer renalen Vasokonstriktion und erhöht den renalen Blutfluss im Streptozotocin-induzierten diabetischen Rattenmodell. Sie erhöht die glomeruläre Filtrationsrate und verringert die Filtrationsfraktion und mildert vaskuläre und tubulointerstitielle Läsionen sowie glomeruläre Schäden.
Diese Chemikalie (25 mg/kg/Tag, p.o.) mildert den Anstieg der renalen, kardialen und retinalen ET-1-, TGF-β1-, VEGF-, FN-, EDB+FN-, Kollagen-α-I(IV)-mRNA-Expression zusammen mit erhöhtem FN-, Kollagenprotein und NF-κB-Aktivierung, die durch Typ-2-Diabetes in db/db-Mäusen induziert werden. Es verbessert auch die mesangiale Expansion, die Herzfunktionsstörung und die erhöhte Expression von ANP und BNP bei diesen diabetischen Mäusen.
Die Behandlung mit dieser Verbindung (100 mg/kg) in Kombination mit Paclitaxel (5 mg/kg) reduzierte die Tumorinzidenz (5/9 vs. 9/9 von Paclitaxel allein) und reduzierte ferner das Tumorgewicht (Median [Bereich]: 0,1 vs. 0,4 g von Paclitaxel allein) und die Inzidenz von Aszites (0/9 vs. 4/9 von Paclitaxel allein) im SKOV3ip1-Ovarialkrebsmodell im Vergleich zu Paclitaxel allein. Es plus Paclitaxel hemmt die Phosphorylierung von ETRs und unterdrückt die Überlebenswege von Tumorzellen durch Verringerung der Spiegel von pVEGFR2, pAkt und pMAPK. Diese Chemikalie verstärkt die Wirkungen von Paclitaxel auf die Zellteilung von Tumorzellen (Brud+-Zellen: 18,5 vs. 30,8 von Paclitaxel allein) und die Apoptose (TUNEL+-Zellen: 195 vs. 150 von Paclitaxel allein).
|
Literatur |
|
Klinische Studieninformationen
(Daten von https://clinicaltrials.gov, aktualisiert am 2024-05-22)
| NCT-Nummer | Rekrutierung | Erkrankungen | Sponsor/Kooperationspartner | Startdatum | Phasen |
|---|---|---|---|---|---|
| NCT05731492 | Recruiting | Arterial Hypertension Pulmonary |
Actelion |
March 14 2024 | Phase 1 |
| NCT05167825 | Recruiting | Pulmonary Arterial Hypertension |
Janssen Pharmaceutical K.K. |
November 14 2022 | Phase 3 |
| NCT05433675 | Completed | Healthy |
Actelion |
June 22 2022 | Phase 1 |
| NCT05392530 | Completed | Healthy |
Actelion |
May 25 2022 | Phase 1 |
| NCT05373108 | Completed | Cardiac Allograft Vasculopathy |
University of California Los Angeles|American Heart Association|Janssen LP |
May 19 2022 | Phase 4 |
Technischer Support
Tel: +1-832-582-8158 Ext:3
Wenn Sie weitere Fragen haben, hinterlassen Sie bitte eine Nachricht.
